
 A、B、C、D、E為原子序數依次增大的短周期元素.A、C處于同一主族,C、D、E處于同一周期;A、B組成的氣體X能使濕潤的紅色石蕊試紙變藍.C在短周期元素中金屬性最強,E原子的最外層電子數是A、B、C原子最外層電子數之和,E的單質與x反應能生成溶于水呈強酸性的化合物Z,同時生成B的單質,D的單質既能與C的最高價氧化物的水溶液反應,也能與Z的水溶液反應;C、E可組成化合物M.
A、B、C、D、E為原子序數依次增大的短周期元素.A、C處于同一主族,C、D、E處于同一周期;A、B組成的氣體X能使濕潤的紅色石蕊試紙變藍.C在短周期元素中金屬性最強,E原子的最外層電子數是A、B、C原子最外層電子數之和,E的單質與x反應能生成溶于水呈強酸性的化合物Z,同時生成B的單質,D的單質既能與C的最高價氧化物的水溶液反應,也能與Z的水溶液反應;C、E可組成化合物M.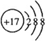 .
.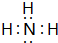 ;
;分析 A、B、C、D、E為原子序數依次增大的短周期元素.A、B組成的氣體X能使濕潤的紅色石蕊試紙變藍,則X為NH3,A為H元素,B為N元素;A、C處于同一主族,C在短周期元素中金屬性最強,C的原子序數大于氮,故C為Na;C、D、E處于同一周期,即處于第三周期,E原子的最外層電子數是A、B、C原子最外層電子數之和,則E原子最外層電子數為1+1+5=7,故E為Cl,E的單質與X反應能生成溶于水呈強酸性的化合物Z,同時生成B的單質,應是氯氣與氨氣反應生成氮氣與HCl,D的單質既能與C的最高價氧化物的水溶液反應,也能與Z的水溶液反應,則D為Al;C、E可組成化合物M為NaCl,據此解答.
解答 解:A、B、C、D、E為原子序數依次增大的短周期元素.A、B組成的氣體X能使濕潤的紅色石蕊試紙變藍,則X為NH3,A為H元素,B為N元素;A、C處于同一主族,C在短周期元素中金屬性最強,C的原子序數大于氮,故C為Na;C、D、E處于同一周期,即處于第三周期,E原子的最外層電子數是A、B、C原子最外層電子數之和,則E原子最外層電子數為1+1+5=7,故E為Cl,E的單質與X反應能生成溶于水呈強酸性的化合物Z,同時生成B的單質,應是氯氣與氨氣反應生成氮氣與HCl,D的單質既能與C的最高價氧化物的水溶液反應,也能與Z的水溶液反應,則D為Al;C、E可組成化合物M為NaCl,.
(1)Cl-離子的結構示意圖為: ,故答案為:
,故答案為: ;
;
(2)X為NH3,其電子式為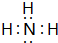 ,故答案為:
,故答案為: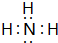 ;
;
(3)Al與氫氧化鈉反應生成偏鋁酸鈉與氫氣,反應離子方程式為:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案為:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(4)E的單質與X反應為:3Cl2+2NH3=N2+6HCl,反應中氧化劑為氯氣,還原劑為氨氣,氧化劑與還原劑的物質的量之比為3:2,故答案為:3:2;
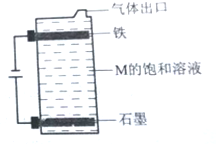
(5)電解NaCl的飽和溶液,石墨電極為陽極,發生氧化反應,氯離子失去電子生成氯氣,陽極發生反應的離子方程式為:2Cl--2e-=Cl2↑;電解時裝置內發生反應的化學方程式為:2NaCl+2H2O$\frac{\underline{\;電解\;}}{\;}$2NaOH+H2↑+Cl2↑,Cl2+2NaOH=NaCl+NaClO+H2O,
故答案為:2Cl--2e-=Cl2↑;2NaCl+2H2O$\frac{\underline{\;電解\;}}{\;}$2NaOH+H2↑+Cl2↑;Cl2+2NaOH=NaCl+NaClO+H2O.
點評 本題考查結構性質位置關系綜合應用,側重對化學用語的考查,推斷元素是解題關鍵,注意對基礎知識的理解掌握.


科目:高中化學 來源: 題型:選擇題
 等質量的鐵與過量的鹽酸在不同的實驗條件下進行反應,測得在不同時間(t)內產生氣體體積(V)的數據如圖所示,根據圖示分析實驗條件,下列說法中一定不正確的是( )
等質量的鐵與過量的鹽酸在不同的實驗條件下進行反應,測得在不同時間(t)內產生氣體體積(V)的數據如圖所示,根據圖示分析實驗條件,下列說法中一定不正確的是( ) | 組別 | 對應曲線 | c(HCl)/mol•L-1 | 反應溫度/℃ | 鐵的狀態 |
| 1 | a | 30 | 粉末狀 | |
| 2 | b | 30 | 粉末狀 | |
| 3 | c | 2.5 | 塊狀 | |
| 4 | d | 2.5 | 30 | 塊狀 |
| A. | 第4組實驗的反應速率最慢 | |
| B. | 第1組實驗中鹽酸的濃度大于2.5 mol•L-1 | |
| C. | 第2組實驗中鹽酸的濃度等于2.5 mol•L-1 | |
| D. | 第3組實驗的反應溫度低于30℃ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 相對原子質量和核外電子數 | B. | 電子層數和最外層電子數 | ||
| C. | 相對原子質量和最外層電子數 | D. | 電子層數和次外層電子數 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 凡是物質的化學變化都伴隨著能量的變化 | |
| B. | 凡是伴隨能量變化的都是化學變化 | |
| C. | 凡是放熱反應都需要加熱 | |
| D. | 凡是放熱反應都不需要加熱 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 所含共用電子對數為($\frac{a}{7}+1$)NA | B. | 所含碳氫鍵數目為$\frac{a{N}_{A}}{7}$ | ||
| C. | 燃燒時消耗的O2一定是$\frac{33.6a}{14}$L | D. | 所含原子總數為$\frac{a{N}_{A}}{14}$ |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 此元素有三種同位素 | |
| B. | 其中質量數為79的同位素原子占原子總數 $\frac{1}{2}$ | |
| C. | 其中一種同位素質量數為80 | |
| D. | 此元素單質的平均相對分子質量為160 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
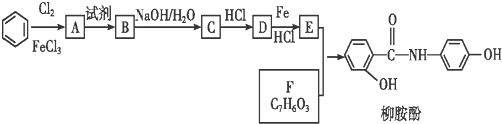
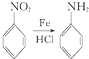
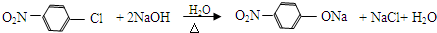
 .
.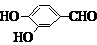 、
、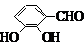 、
、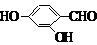 、
、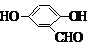 (其中三種)(寫出3種).
(其中三種)(寫出3種).查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com