
(1)請按要求填寫化學方程式:
①硫酸銅電離方程式為
________________________________________________________________________。
②硫酸銅水解的離子方程式為
________________________________________________________________________。
③硫酸銅溶液與氫氧化鋇反應的離子方程式為____
____________________________________________________________________
________________________________________________________________________。
(2)①向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至中性,發生反應的離子方程式為____
____________________________________________________________________
________________________________________________________________________;
在上述溶液中,繼續滴加Ba(OH)2溶液,此步反應的離子方程式為____
____________________________________________________________________。
②向Ba(OH)2溶液中,逐滴加入明礬溶液至Ba2+恰好完全沉淀,其反應的離子方程式為
________________________________________________________________________
________________________________________________________________________;
在上述溶液中,繼續滴加明礬溶液,此步反應的離子方程式為___
_____________________________________________________________________。
(3)完成下列離子方程式:
①KOH溶液與足量Ca(HCO3)2溶液反應
________________________________________________________________________;
②KOH溶液與少量Ca(HCO3)2溶液反應
________________________________________________________________________;
③Ca(OH)2溶液與足量NaHCO3溶液反應
________________________________________________________________________;
④足量Ca(OH)2溶液與NaHCO3溶液反應
________________________________________________________________________。
解析 (1)應當注意區別三類反應方程式在寫法上的不同。(2)Ba(OH)2與NaHSO4的反應較特殊,應充分注意判斷在反應中哪種物質過量;Ba(OH)2與明礬的反應存在Ba2+與SO![]() 、OH-與Al3+的兩個反應,在判斷反應過量問題時應同時考慮。(3)①因Ca(HCO3)2是足量的,KOH的量相對較少,OH-與HCO
、OH-與Al3+的兩個反應,在判斷反應過量問題時應同時考慮。(3)①因Ca(HCO3)2是足量的,KOH的量相對較少,OH-與HCO![]() 反應,產物中有H2O和CO
反應,產物中有H2O和CO![]() ,還剩余HCO
,還剩余HCO![]() 未反應。
未反應。
答案 (1)①CuSO4===Cu2++SO![]()
②Cu2++H2OCu(OH)2+2H+
③Ba2++SO![]() +2OH-+Cu2+===BaSO4↓+Cu(OH)2↓
+2OH-+Cu2+===BaSO4↓+Cu(OH)2↓
(2)①2H++SO![]() +2OH-+Ba2+===BaSO4↓+2H2O
+2OH-+Ba2+===BaSO4↓+2H2O
Ba2++SO![]() ===BaSO4↓
===BaSO4↓
②Al3++2SO![]() +4OH-+2Ba2+===2BaSO4↓+AlO
+4OH-+2Ba2+===2BaSO4↓+AlO![]() +2H2O Al3++3AlO
+2H2O Al3++3AlO![]() +6H2O===4Al(OH)3↓
+6H2O===4Al(OH)3↓
(3)①OH-+Ca2++HCO![]() ===CaCO3↓+H2O
===CaCO3↓+H2O
②2OH-+Ca2++2HCO![]() ===CaCO3↓+2H2O+CO
===CaCO3↓+2H2O+CO![]()
③Ca2++2OH-+2HCO![]() ===CaCO3↓+2H2O+CO
===CaCO3↓+2H2O+CO![]()
④HCO![]() +Ca2++OH-===CaCO3↓+H2O
+Ca2++OH-===CaCO3↓+H2O


科目:高中化學 來源: 題型:閱讀理解
 (2010?四川)碘被稱為“智力元素”,科學合理地補充碘可防止碘缺乏病.碘酸鉀(KIO3)是國家規定的食鹽加碘劑,它的晶體為白色,可溶于水.碘酸鉀在酸性介質中與過氧化氫或碘化物作用均生成單質碘.以碘為原料,通過電解制備碘酸鉀的實驗裝置如圖所示.請回答下列問題:
(2010?四川)碘被稱為“智力元素”,科學合理地補充碘可防止碘缺乏病.碘酸鉀(KIO3)是國家規定的食鹽加碘劑,它的晶體為白色,可溶于水.碘酸鉀在酸性介質中與過氧化氫或碘化物作用均生成單質碘.以碘為原料,通過電解制備碘酸鉀的實驗裝置如圖所示.請回答下列問題:| 實驗方法 | 實驗現象及結論 |
取少量陽極區電解液于試管中,加稀硫酸酸化后加入幾滴淀粉溶液,觀察是否變藍. 取少量陽極區電解液于試管中,加稀硫酸酸化后加入幾滴淀粉溶液,觀察是否變藍. |
如果不變藍,說明無I-.(如果變藍,說明有I-) 如果不變藍,說明無I-.(如果變藍,說明有I-) |

查看答案和解析>>
科目:高中化學 來源: 題型:
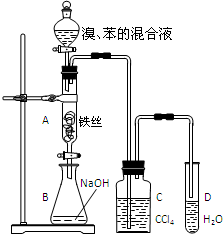 某化學課外小組用如圖裝置制取溴苯并探究該反應的類型.先向分液漏斗中加入苯和液溴,再將混合液滴入反應器A(A下端活塞關閉)中.
某化學課外小組用如圖裝置制取溴苯并探究該反應的類型.先向分液漏斗中加入苯和液溴,再將混合液滴入反應器A(A下端活塞關閉)中.| Fe |
| Fe |
| 向試管D中加入的試劑 | 能證明苯與液溴發生取代反應的現象 | |
| 方法一 | ||
| 方法二 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| NaOH溶液 |
| 酸化 |
| NaOH溶液 |
| 酸化 |
| NaOH溶液 |
| 酸化 |


| 實驗步驟 | 所用試劑 | 現 象 | 結 論 |
| 1 | |||
| 2 | |||
| 3 | |||
| 4 |


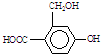 為實現以下物質的轉化
為實現以下物質的轉化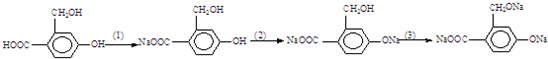
查看答案和解析>>
科目:高中化學 來源:物理教研室 題型:058

(1)溶解樣品所用的儀器是________。
(2)向樣品溶液中加入的A溶液是________;
A要酸化的目的是________;不用硝酸酸化的原因是________;A要過量的原因是________。
(3)通過檢驗無色溶液a來判斷A是否過量。取少許a溶液,滴加________,若則表明A已過量。
(4)白色沉淀b在烘干前,應在過濾器中用蒸餾水多次洗滌,其原因是________;為了檢驗沉淀是否洗凈,應在最后幾滴洗出液中滴加________,若________則表明沉淀已洗凈。
(5)通過以上實驗測定,其樣品純度的數學表達式為________。
查看答案和解析>>
科目:高中化學 來源: 題型:058
有一純凈的亞硫酸鈉試劑,因部分氧化而變質,為了測定試劑的純度,根據下圖所給出的方案進行實驗,請按要求填寫以下各項空白。

(1)溶解樣品所用的儀器是________。
(2)向樣品溶液中加入的A溶液是________;
A要酸化的目的是________;不用硝酸酸化的原因是________;A要過量的原因是________。
(3)通過檢驗無色溶液a來判斷A是否過量。取少許a溶液,滴加________,若則表明A已過量。
(4)白色沉淀b在烘干前,應在過濾器中用蒸餾水多次洗滌,其原因是________;為了檢驗沉淀是否洗凈,應在最后幾滴洗出液中滴加________,若________則表明沉淀已洗凈。
(5)通過以上實驗測定,其樣品純度的數學表達式為________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com