
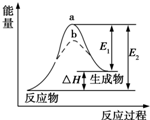
| A. | 如圖可知a一定使用了催化劑 | |
| B. | 該反應為放熱反應,△H=E1-E2 | |
| C. | 使用催化劑,可以改變化學平衡常數 | |
| D. | 使用催化劑,可降低該反應的活化能 |
分析 A.加入催化劑會降低反應的活化能;
B.根據圖象分析可知反應物能量低于生成物能量,為吸熱反應;
C.加入催化劑不會改變化學反應平衡;
D.催化劑能降低反應的活化能,從而加快化學反應速率;
解答 解:A.催化劑會降低反應的活化能,a、b分別對應無催化劑和有催化劑的能量變化,故A錯誤;
B.焓變△H=E2-E1,反應為吸熱反應,故B錯誤;
C.加入催化劑不會改變化學反應的平衡,化學平衡常數不變,故C錯誤.
D.催化劑能降低反應的活化能,從而加快化學反應速率,故D正確;
故選D.
點評 本題考查了反應能量變化的分析判斷,圖象分析是解題關鍵,反應的能量守恒是判斷的依據,注意加入催化劑不會改變化學平衡,會降低反應的活化能,題目較簡單.


科目:高中化學 來源: 題型:選擇題
| A. | 4 v(NH3)=5 v(O2) | B. | 5v(O2)=6 v(H2O) | C. | 2 v(NH3)=3 v(H2O) | D. | 4v(O2)=5 v(NO) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 太陽能、地熱能、核能、化石燃料等均屬于“新能源” | |
| B. | 減少含碳物質做燃料符合“低碳”理念 | |
| C. | 圖中轉化途徑不能體現“節能減排”的思想 | |
| D. | 節約用電不能減少CO2的排放量 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
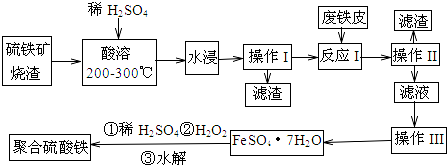
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CH4(g)+$\frac{3}{2}$O2(g)═CO(g)+2H2O(l)△H=-890.3kJ•mol-1 | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 | |
| C. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=+890.3kJ•mol-1 | |
| D. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ•mol-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 實驗序號 | 鹽酸體積(mL) |
| 第一組 | 19.90 |
| 第二組 | 24.70 |
| 第三組 | 20.10 |
| 第四組 | 20.00 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
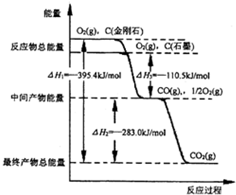 CO2是一種主要的溫室氣體,研究CO2的利用對促進低碳社會的構建具有重要的意義.
CO2是一種主要的溫室氣體,研究CO2的利用對促進低碳社會的構建具有重要的意義.| 化學鍵 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 鍵能/kJ•mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com