
| A. | 恒溫恒容:操作1:加1 mol N2+3 molH2,操作2:加2 mol NH3 | |
| B. | 恒溫恒壓:操作1:加1 mol N2+3 molH2,操作2:加2 mol NH3 | |
| C. | 恒溫恒容:操作1:加1 mol N2+3 molH2,操作2:加3 mol NH3 | |
| D. | 恒溫恒壓:操作1:加1 mol N2+3 molH2,操作2:加3 mol NH3 |
分析 A、該反應正反應是氣體體積減少的反應,恒溫恒容下,加操作2轉化到左邊,可得1 mol N2+3 mol H2,與操作1對應各組分的物質的量相等,與操作1為等效平衡,平衡時NH3的物質的量相同,令操作1中N2的轉化率為a,由方程式可知平衡時NH3為2amol;操作2中 NH3的轉化率為b,平衡時NH3為2(1-b)mol,據此計算判斷;
B、該反應正反應是氣體體積減少的反應,恒溫恒壓下,加操作2轉化到左邊,可得1 mol N2+3 mol H2,與操作1對應各組分的物質的量之比相等,與操作1為等效平衡,平衡時NH3的含量相同,令操作1中N2的轉化率為a,由方程式可知平衡時NH3為2amol,平衡時總的物質的量為(4+2a)mol;操作2中 NH3的轉化率為b,平衡時NH3為2(1-b)mol,總的物質的量為(2+2b)mol,根據含量相同計算判斷;
C、該反應正反應是氣體體積減少的反應,恒溫恒容下,加操作2轉化到左邊,可得1.5 mol N2+4.5mol H2,與操作1對應各組分的物質的量不相等,與操作1不是等效平衡,可等效為在操作2在操作1的基礎上增大壓強,平衡時NH3含量增大、物質的量比操作1增大,令操作1中N2的轉化率為a,由方程式可知平衡時NH3為2amol,平衡時總的物質的量為(4+2a)mol;操作2中 NH3的轉化率為b,平衡時NH3為3(1-b)mol,總的物質的量為(3+3b)mol,根據平衡是氨氣的含量計算判斷;
D、該反應正反應是氣體體積減少的反應,恒溫恒壓下,加操作2轉化到左邊,可得1.5mol N2+4.5mol H2,與操作1對應各組分的物質的量之比相等,與操作1為等效平衡,平衡時NH3的含量相同,令操作1中N2的轉化率為a,由方程式可知平衡時NH3為2amol,平衡時總的物質的量為(4+2a)mol;操作2中 NH3的轉化率為b,平衡時NH3為3(1-b)mol,總的物質的量為(3+3b)mol,根據含量相同計算判斷.
解答 解:A、該反應正反應是氣體體積減少的反應,恒溫恒容下,加操作2轉化到左邊,可得1 mol N2+3 mol H2,與操作1對應各組分的物質的量相等,與操作1為等效平衡,平衡時NH3的物質的量相同,令操作1中N2的轉化率為a,由方程式可知平衡時NH3為2amol;操作2中 NH3的轉化率為b,平衡時NH3為2(1-b)mol,所以有2amol=2(1-b)mol,整理得a+b=1,故A不符合;
B、該反應正反應是氣體體積減少的反應,恒溫恒壓下,加操作2轉化到左邊,可得1 mol N2+3 mol H2,與操作1對應各組分的物質的量之比相等,與操作1為等效平衡,平衡時NH3的含量相同,令操作1中N2的轉化率為a,由方程式可知平衡時NH3為2amol,平衡時總的物質的量為(4+2a)mol;操作2中 NH3的轉化率為b,平衡時NH3為2(1-b)mol,總的物質的量為(2+2b)mol,所以$\frac{2a}{4+2a}$=$\frac{2(1-b)}{2+2b}$,整理得a+b=1,故B不符合;
C、該反應正反應是氣體體積減少的反應,恒溫恒容下,加操作2轉化到左邊,可得1.5 mol N2+4.5mol H2,與操作1對應各組分的物質的量不相等,與操作1不是等效平衡,可等效為在操作2在操作1的基礎上增大壓強,平衡時NH3含量增大、物質的量比操作1增大,令操作1中N2的轉化率為a,由方程式可知平衡時NH3為2amol,平衡時總的物質的量為(4+2a)mol;操作2中 NH3的轉化率為b,平衡時NH3為3(1-b)mol,總的物質的量為(3+3b)mol,所以$\frac{2a}{4-2a}$<$\frac{3(1-b)}{3+3b}$,整理得a+b<1,故C符合;
D、該反應正反應是氣體體積減少的反應,恒溫恒壓下,加操作2轉化到左邊,可得1.5mol N2+4.5mol H2,與操作1對應各組分的物質的量之比相等,與操作1為等效平衡,平衡時NH3的含量相同,令操作1中N2的轉化率為a,由方程式可知平衡時NH3為2amol,平衡時總的物質的量為(4+2a)mol;操作2中 NH3的轉化率為b,平衡時NH3為3(1-b)mol,總的物質的量為(3+3b)mol,所以所以$\frac{2a}{4+2a}$=$\frac{3(1-b)}{3+3b}$,整理得a+b=1,故D不符合;
故選C.
點評 本題考查化學平衡計算、平衡移動、等效平衡等,難度中等,理解等效平衡規律、判斷平衡移動是解題的關鍵.


科目:高中化學 來源: 題型:解答題

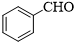 .
. .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 實驗編號 | c(HA)/mol•L-1 | c(NaOH)/mol•L-1 | 反應后溶液pH |
| 甲 | 0.1 | 0.1 | 9 |
| 乙 | c1 | 0.2 | 7 |
| A. | 甲:反應后溶液中 c(Na+)>c(A-)>c(OH-)>c(H+) | |
| B. | 乙:反應后溶液中 c(Na+)=c(HA)+c(A-) | |
| C. | 甲中由水電離產生的c(H+)=1×10-9 mol•L-1 | |
| D. | 乙中c1一定大于0.2 mol•L-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 5 | B. | 3 | C. | 2 | D. | 4 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 某儲能電池的原理如右圖所示,溶液中c(H+)=2.0mol/L,陰離子為SO42-,a、b均為惰性電極,充電時右槽的電極反應為V3++e-=V2+.下列敘述正確的是( )
某儲能電池的原理如右圖所示,溶液中c(H+)=2.0mol/L,陰離子為SO42-,a、b均為惰性電極,充電時右槽的電極反應為V3++e-=V2+.下列敘述正確的是( )| A. | 放電時,外電路的電子由a極移向b極 | |
| B. | 放電時,溶液中H+從左槽移向右槽 | |
| C. | 充電時,a極的反應式為VO2+-e-+H2O=VO2++2H+ | |
| D. | 當左槽溶液顏色由藍色變為黃色時,電池中能量轉化形式為化學能轉化為電能 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | BaSO4在熔化狀態下導電的本質原因是其中存在自由移動的離子 | |
| B. | 氯化銀難溶于水,故其水溶液不導電 | |
| C. | 液態HCl中含有自由移動的Cl- | |
| D. | 電離是電解質在通電的作用下離解成自由移動的離子的過程 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
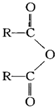 $\stackrel{H_{2}O}{→}$2RCOOH(其中R是烴基)
$\stackrel{H_{2}O}{→}$2RCOOH(其中R是烴基)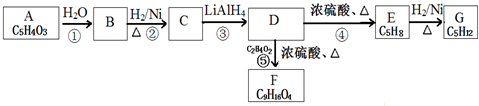
 ,CH2=C(CH3)CH=CH2.
,CH2=C(CH3)CH=CH2.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①② | B. | ③④ | C. | ②③ | D. | ②③④ |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
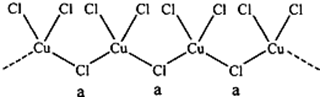
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com