


 黃岡小狀元解決問題天天練系列答案
黃岡小狀元解決問題天天練系列答案 三點一測快樂周計劃系列答案
三點一測快樂周計劃系列答案科目:高中化學 來源: 題型:
查看答案和解析>>
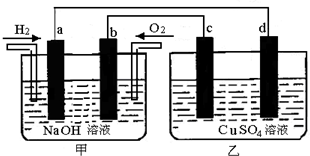
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
 實際上電離平衡、鹽的水解平衡等,它們都可看作是化學平衡的一種.請根據所學化學知識回答下列問題:
實際上電離平衡、鹽的水解平衡等,它們都可看作是化學平衡的一種.請根據所學化學知識回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:

查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
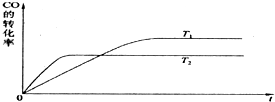
 歐盟原定于2012年1月1日起征收航空碳排稅以應對冰川融化和全球變暖,使得對如何降低大氣中CO2的含量及有效地開發利用碳資源的研究顯得更加緊迫.請運用化學反應原理的相關知識研究碳及其化合物的性質.
歐盟原定于2012年1月1日起征收航空碳排稅以應對冰川融化和全球變暖,使得對如何降低大氣中CO2的含量及有效地開發利用碳資源的研究顯得更加緊迫.請運用化學反應原理的相關知識研究碳及其化合物的性質.| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com