
 實驗小組同學看到一則報道:某造紙廠誤將槽車中漂白液(NaCl和NaClO的混合液)倒入盛放飽和KAl(SO4)2溶液的池中,造成中毒事件.該小組同學為探究中毒原因進行了如下實驗.
實驗小組同學看到一則報道:某造紙廠誤將槽車中漂白液(NaCl和NaClO的混合液)倒入盛放飽和KAl(SO4)2溶液的池中,造成中毒事件.該小組同學為探究中毒原因進行了如下實驗.分析 (1)①NaClO為強堿弱酸鹽,水解顯堿性;
②Ⅱ中由白色沉淀生成,經檢驗白色沉淀不溶于鹽酸,可知白色沉淀為BaSO4,發生氧化還原反應;
Ⅳ中加入少量稀硫酸酸化后,溶液紅色立即變為無色,生成HClO,氧化性增強;
(2)①漂白液在酸性溶液中有Cl2生成,則分液漏斗中為酸,B中盛放NaOH溶液吸收氯氣,以此來解答;
②次氯酸鈣和氯化鈣加入硫酸發生氧化還原反應生成氯氣硫酸鈣和水;
③燒瓶中加入飽和KAl(SO4)2溶液,次氯酸根離子水解顯堿性,鋁離子水解顯酸性,混合后水解相互促進,產生大量的白色膠狀沉淀和次氯酸;
(3)過量的SO2氣體通入漂白液中,次氯酸具有氧化性氧化二氧化硫為硫酸,發生氧化還原反應,結合鋇離子生成硫酸鋇白色沉淀.
解答 解:(1)①NaClO為強堿弱酸鹽,水解顯堿性,水解離子反應為ClO-+H2O?HClO+OH-,故答案為:ClO-+H2O?HClO+OH-;
②Ⅱ中由白色沉淀生成,經檢驗白色沉淀不溶于鹽酸,可知白色沉淀為BaSO4,發生氧化還原反應,反應的離子方程式為:Ba2++ClO-+SO32-=BaSO4↓+Cl-;,
故答案為:Ba2++ClO-+SO32-=BaSO4↓+Cl-;
③Ⅳ中加入少量稀硫酸酸化后,溶液紅色立即變為無色,生成HClO,氧化性增強,
由上述兩個實驗對比可知,加入酸,反應速率加快,則ClO-的氧化性隨氫離子濃度增大而增大,
故答案為:ClO-的氧化性隨氫離子濃度增大而增大;
(2)①漂白液在酸性溶液中有Cl2生成,則分液漏斗中為酸,B中盛放NaOH溶液,其作用為吸收氯氣、防止污染空氣,
故答案為:吸收氯氣防止污染空氣;
②次氯酸鈣和氯化鈣加入硫酸發生氧化還原反應生成氯氣硫酸鈣和水,反應的離子方程式為:ClO-+Cl-+2H+=Cl2↑+H2O,
故答案為:ClO-+Cl-+2H+=Cl2↑+H2O;
③燒瓶中加入飽和KAl(SO4)2溶液,次氯酸根離子水解顯堿性,鋁離子水解顯酸性,混合后水解相互促進,產生大量的白色膠狀沉淀和次氯酸,反應的離子方程式為:
3ClO-+Al3++3H2O=3HClO+Al(OH)3↓,將燒瓶中的混合液在陽光照射下,不久燒瓶中有黃綠色氣體產生為氯氣,充分反應后集氣瓶中收集到一種無色無味的氣體為氧氣.依據氧化還原反應電子守恒寫出化學方程式配平得到:4HClO$\frac{\underline{\;光照\;}}{\;}$2H2O+2Cl2↑+O2↑,
故答案為:3ClO-+Al3++3H2O=3HClO+Al(OH)3↓;
(3)過量的SO2氣體通入漂白液中,次氯酸具有氧化性氧化二氧化硫為硫酸,發生氧化還原反應,結合鋇離子生成硫酸鋇白色沉淀,
故答案為:生成白色沉淀.
點評 本題考查了次氯酸鹽的性質分析判斷,主要是氧化性和產物分析,離子方程式書寫方法,掌握基礎是解題關鍵,題目難度中等.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:多選題
| A. | 標準狀況下,22.4L H2含有的原子數為NA | |
| B. | 等質量的O2和O3中所含的氧原子數相同 | |
| C. | 常溫常壓下,14g N2含有電子數為7NA | |
| D. | 等質量的CO與CO2中所含碳原子數之比為7﹕11 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 活潑的金屬粉塵遇明火均易引起爆炸 | |
| B. | 任何金屬粉末在不正確操作下均可能引起爆炸 | |
| C. | 汽車輪轂表面鍍鋁既增加美觀度,又耐腐蝕 | |
| D. | 事故告誡人們安全生產,防污、防爆非常重要 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Cu2S在反應中既是氧化劑又是還原劑 | |
| B. | 以上反應中轉移電子的物質的量為1 mol | |
| C. | 以上參加反應的HNO3中被還原的HNO3為2 mol | |
| D. | 反應中,氧化劑和還原劑的物質的量之比為4:3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 濾液A中不含Fe3+ | |
| B. | 樣品中含氧元素的物質的量為0.01mol | |
| C. | 上圖中V=112 | |
| D. | 溶解樣品的過程中消耗的硫酸的總的物質的量為0.02mol |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
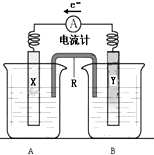 如圖是銅鋅原電池裝置.其電池的總反應是:
如圖是銅鋅原電池裝置.其電池的總反應是:查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 升高溫度,活化分子百分數增大,有效碰撞的幾率增大,反應速率增大 | |
| B. | 增大反應物濃度,單位體積內活化分子數增多,有效碰撞的幾率增大,反應速率增大 | |
| C. | 具有足夠能量的分子相互碰撞就一定能發生化學反應 | |
| D. | 正催化劑能降低反應的活化能,提高活化分子百分數,有效碰撞的幾率增大,反應速率增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 負極:4OH--4e-═O2+2H2O | B. | 負極:H2+2OH--2e-═2H2O | ||
| C. | 正極:O2+4e-═4O2- | D. | 正極:H2-2e-═2H+ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com