
【題目】20℃時,用0. 1mol/L 鹽酸滴定20mL 0. 1mol/L 氨水的圖像如圖所示,下列說法正確的是
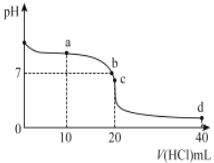
A.a點時2c(Cl-)=c(NH3H2O)+c (NH4+)
B.b點表示酸堿恰好完全反應
C.c點時c(NH4+)>c(Cl-)>c(H+ )>c(OH- )
D.a 、b、c、d均有c(NH4+)+c(H+) = c(Cl-)+c(OH-)
【答案】AD
【解析】
用0. 1mol/L 鹽酸滴定20mL 0. 1mol/L 氨水的過程中溶液中的溶質的變化依次為:氨水、氨水和氯化銨、氯化銨、氯化銨和鹽酸,溶液中的pH變化為從大到小。
A. a點時加入10mL的鹽酸,溶液中的溶質為等物質的量的氨水和氯化銨,根據物料守恒有氮原子的物質的量是氯原子的物質的量的2倍,即2c(Cl-)=c(NH3H2O)+c (NH4+),故A正確;
B.酸堿恰好完全反應時應該加入0. 1mol/L 鹽酸20mL,即酸堿恰好完全反應的點為c點,而不是b點,故B錯誤;
C. c點溶液中的溶質為氯化銨,顯酸性,根據電荷守恒可知正確的離子排序為c(Cl-)> c(NH4+)>c(H+ )>c(OH- ),故C錯誤;
D. a 、b點溶液中的溶質為氨水和氯化銨,c點溶液中的溶質為氯化銨,d點溶液中的溶質為氯化銨和鹽酸,根據電荷守恒都有c(NH4+)+c(H+) = c(Cl-)+c(OH-),故D正確;
綜上所述,答案為AD。


科目:高中化學 來源: 題型:
【題目】金屬鈦因為其優越的性能被稱為“未來金屬”,其工業冶煉涉及到的反應如下:TiO2+2C+2Cl2 TiCl4+2CO。回答下列相關問題:
TiCl4+2CO。回答下列相關問題:
(1)基態鈦原子的價層電子排布式為____ ,上述反應中非金屬元素電負性由大到小是______;
(2)已知部分物質熔沸點如下:
名稱 | 金紅石 | 金剛石 | 四氯化鈦 | 四溴化鈦 | 四碘化鈦 |
化學式 | TiO2 | C | TiCl4 | TiBr4 | TiI4 |
熔點/℃ | 1830 | 3550 | -24.1 | 38 | 150 |
沸點/℃ | 2927 | 4827 | 136.4 | 233.1 | 377.2 |
自左向右,表中的三種鈦的鹵化物熔沸點依次升高的原因是__________。
(3)配位數為6,組成為TiCl36H2O 的晶體有兩種:化學式為[TiCl(H2O)5]Cl2H2O的X呈綠色,定量實驗表明,X與AgNO3以1:2物質的量比反應生成沉淀。Y呈紫色,且Y與AgNO3 以1:3物質的量之比反應生成沉淀,則Y的化學式為 ______。
(4)鈣鈦礦是重要的含鈦礦物之一。其主要成分Z 的晶胞如圖所示。推測Z的化學式為__________,Ca填充在O圍成的_________空隙中。

(5)若晶胞參數 a=384.1pm,Z晶體的密度為 _________列出計算表達式并計算出兩位有效數字結果,3.8413≈56.67,阿伏加德羅常數用 6.0×1023 mol-1)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】回答下列問題:
(1)![]() 溶液顯酸性,試用離子方程式解釋其原因________。
溶液顯酸性,試用離子方程式解釋其原因________。
(2)氯化銀在水中存在沉淀溶解平衡:AgCl(s)Ag+(aq)+Cl-(aq),在25C時,氯化銀的![]() ,現將足量氯化銀分別放入:①
,現將足量氯化銀分別放入:①![]() 氯化鎂溶液中,②
氯化鎂溶液中,②![]() 硝酸銀溶液中,③
硝酸銀溶液中,③![]() 氯化鋁溶液中,④
氯化鋁溶液中,④![]() 鹽酸溶液中。充分攪拌后,相同溫度下銀離子濃度由大到小的順序是___________(填寫序號)。
鹽酸溶液中。充分攪拌后,相同溫度下銀離子濃度由大到小的順序是___________(填寫序號)。
(3)下表所示的是常溫下,某些弱酸的電離常數,請根據要求作答。
弱酸 | 電離常數 | 弱酸 | 電離常數 |
|
|
|
|
|
|
|
|
①相同物質的量濃度的![]() 和
和![]() 的混合溶液中離子濃度由大到小的順序為_________。
的混合溶液中離子濃度由大到小的順序為_________。
②請判斷![]() 溶液顯_________性(填“酸”、“堿”或“中”)。
溶液顯_________性(填“酸”、“堿”或“中”)。
③下列離子方程式書寫正確的是_______。
A. HC2O4-+SO32-═HSO3-+C2O42-
B. 2CH3COOH+SO32-═2CH3COO-+H2O+SO2↑
C. SO2+H2O+2CH3COO-═2CH3COOH+SO32-
D. 2CO32-+SO2+H2O═2HCO3-+SO32-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】室溫下將0.1mol·L-1的燒堿溶液不斷滴加到10.00mL相同濃度的HA溶液中,溶液中-lgc水(H+)與NaOH溶液的體積關系如圖所示[注:c水(H+)為溶液中水電離的c(H+)]。下列說法不正確的是( )
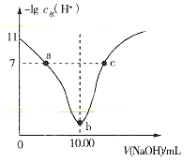
A.a、c兩點溶液中均存在:c(H+)+c(Na+)=c(OH-)+c(A-)
B.b點溶液中存在:c(H+)+c(HA)=c(OH-)
C.a、b、c三點溶液中,b點溶液導電性最強
D.0.1mol·L-1HA溶液中HA的電離度約為1%
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室中有一未知濃度的稀鹽酸,某同學為測定該鹽酸的濃度,在實驗室中進行了如下實驗。
(1)配制100 mL 0.10 mol/L NaOH標準溶液。
①主要操作步驟:計算→稱量→溶解→冷卻→轉移→洗滌(并將洗滌液移入容量瓶)→振蕩→_________→__________→裝瓶→貼標簽。
②稱量________g氫氧化鈉固體粉末,所需儀器有:托盤天平(帶砝碼和鑷子)、___________、小燒瓶。
(2)取20.00 mL待測鹽酸溶液放入錐形瓶中,并滴加2~3滴酚酞作指示劑,用自己配制的標準液NaOH溶液進行滴定。重復上述滴定操作2~3次,記錄數據如下:
實驗 編號 | NaOH溶液的濃度(mol/L) | 滴定完成時,NaOH溶液滴入的體積(mL) | 待測鹽酸溶液的體積(mL) | |
1 | 0.10 | 29.80 | 20.00 | |
2 | 0.10 | 30.00 | 20.00 | |
3 | 0.10 | 30.20 | 20.00 |
①滴定達到終點的標志是___________________________。
②根據上述數據,可計算出該鹽酸的濃度約為_______(保留兩位有效數字)。
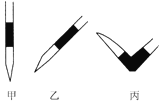
③排去堿式滴定管中氣泡的方法應采用如圖所示操作中的____________(選擇甲、乙、丙填空),然后輕輕擠壓玻璃球使尖嘴部分充滿堿液。
④在上述實驗中,下列操作(其他操作正確)會造成測定結果偏高的有_______。
A.滴定終點讀數時俯視讀數
B.酸式滴定管使用前,水洗后未用待測鹽酸溶液潤洗
C.錐形瓶水洗后未干燥
D.滴定過程中,有少量標準液濺出錐形瓶外
E.堿式滴定管尖嘴部分有氣泡,滴定后消失
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】科學家分析,地球原始大氣中的COS(羰基硫)對氨基酸縮合形成多肽的反應有催化作用,對生命起源起到重要作用。
(1)寫出COS的電子式________,C與O形成共價鍵時,共用電子對會偏向____原子,判斷依據是___________。
(2)已知 COS(g)+ H2O(g)![]() H2S(g)+ CO2(g) ΔH1 = - 34kJ/mol
H2S(g)+ CO2(g) ΔH1 = - 34kJ/mol
CO(g)+ H2O(g)![]() H2(g)+ CO2(g) ΔH2 = - 41kJ/mol
H2(g)+ CO2(g) ΔH2 = - 41kJ/mol
寫出H2S與CO反應生成 COS 的熱化學方程式:_________;100℃ 時將CO與H2S按物質的量比為 1:1 充入反應器中,達平衡后CO的轉化率α = 33.3%,此時反應的平衡常數K =______。
(3)在充有催化劑的恒壓密閉容器中進行反應。 設起始充入的 n(CO):n(H2S)=m,相同時間內測得H2S轉化率與m和溫度(T)的關系如圖所示。

①m1________m2。(填“ > ”、“ < ”或“ = ”)
②溫度高于 T0時,H2S 轉化率減小的可能原因為________。
A 反應停止了
B 反應的 ΔH 變大
C 反應達到平衡
D 催化劑活性降低
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學興趣小組利用硫酸鐵溶液與銅粉反應,又向反應后溶液中加入KSCN溶液以檢驗Fe3+是否有剩余,實驗記錄如下;
實驗編號 | 操作 | 現象 |
實驗1 |
| i.加入Cu粉后充分振蕩,溶液逐漸變藍; ii.取少量i中清液于試管中,滴加2滴 0.2mol/LKSCN溶液,溶液變為紅色,但振蕩后紅色迅速褪去并有白色沉淀生成。 |
(1)寫出實驗1中第i步的離子方程式_______________。甲同學猜想第ii步出現的異常現象是由于溶液中的Cu2+干擾了檢驗Fe3+的現象。查閱相關資料如下
①2Cu2++4SCN- ![]() 2CuSCN↓(白色)+(SCN)2(黃色)
2CuSCN↓(白色)+(SCN)2(黃色)
②硫氰[(SCN)2]:是一種擬鹵素,性質與鹵素單質相似,其氧化性介于Br2和I2之間。
該同學又通過如下實驗驗證猜想
實驗編號 | 操作 | 現象 |
實驗2 |
| 溶液呈綠色,一段時間后后開始出現白色沉淀,上層溶液變為黃色 |
實驗3 |
| 無色溶液立即變紅,同時生成白色沉淀。 |
(2)經檢測,實驗2反應后的溶液pH值減小,可能的原因是___________________________________________。
(3)根據實驗2、3的實驗現象,甲同學推斷實驗3中溶液變紅是由于Fe2+被(SCN)2氧化,寫出溶液變紅的離子方程式_______________________。繼續將實驗2中的濁液進一步處理,驗證了這一結論的可能性。

補充實驗4的目的是排除了溶液存在Cu2+的可能,對應的現象是____________________________________________。
(4)乙同學同時認為,根據氧化還原反應原理,在此條件下,Cu2+也能氧化Fe2+,他的判斷依據是_______。
(5)為排除干擾,小組同學重新設計如下裝置。
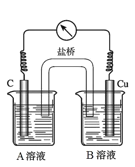
①A溶液為____________________________。
②“電流表指針偏轉,說明Cu與Fe3+發生了反應”,你認為這種說法是否合理?__________________(填合理或不合理),原因是__________________________________________。
③驗證Fe3+是否參與反應的操作是________________________________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】機動車排放的污染物主要有碳氫化合物、一氧化碳和氮氧化物等。
I.汽油燃油車上安裝三元催化轉化器,可有效降低汽車尾氣污染。
(1)已知: C(s)+O2(g) = CO2(g) △H1 = 393.5kJ·mol1
2C(s)+O2(g) = 2CO(g) △H2 = 221.0 kJ·mol1
N2(g)+O2(g) = 2NO(g) △H 3 =+180.5 kJ·mol1
CO和NO兩種尾氣在催化劑作用下生成N2的熱化學方程式是_________________________。
(2)研究CO和NO的催化反應,用氣體傳感器測得在某溫度下、一定體積的密閉容器中,不同時間NO和CO濃度如下表:
時間(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/(______)4mol·L1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)/(______)3mol·L1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
① 前4 s內的平均反應速率υ(CO) =______mol·L1·s1。
② L、X可分別代表壓強或溫度。下圖A表示L一定時,NO(g)的平衡轉化率隨X的變化關系。X代表的物理量是______。判斷L1、L2的大小關系,并簡述理由:______________________________。
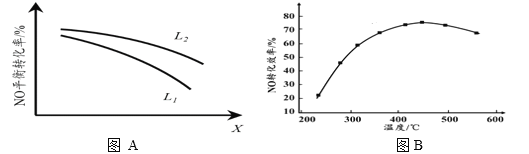
(3)實驗測得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2) ·c2(CO2)(k正、k逆為速率常數,只與溫度有關)。
①達到平衡后,僅升高溫度,k正增大的倍數______(填“>”、“<
②若在2 L的密閉容器中充入1 mol CO和1 mol NO,在一定溫度下達到平衡時,CO的轉化率為40%,則k正︰k逆 =___________。(保留一位小數)
II. 有人利用反應C(s)+2NO(g) ![]() N2(g)+CO2(g) ΔH = 34.0 kJ·mol1,用活性炭對NO進行吸附。現在密閉容器中加入足量的C和一定量的NO氣體并在催化劑作用下發生反應,經相同時間測得NO的轉化率隨溫度的變化如圖B所示。由圖可知最高轉化率對應溫度為450℃。低于450℃時,NO的轉化率是不是對應溫度下的平衡轉化率及判斷理由是________________________;
N2(g)+CO2(g) ΔH = 34.0 kJ·mol1,用活性炭對NO進行吸附。現在密閉容器中加入足量的C和一定量的NO氣體并在催化劑作用下發生反應,經相同時間測得NO的轉化率隨溫度的變化如圖B所示。由圖可知最高轉化率對應溫度為450℃。低于450℃時,NO的轉化率是不是對應溫度下的平衡轉化率及判斷理由是________________________;
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國科學家最近成功合成了世界上首個五氮陰離子鹽(N5)6(H3O)3(NH4)4Cl(用 R代表)。 回答下列問題:
(1)基態氮原子價層電子的軌道表示式為_____。
(2)氯離子的基態電子排布式為_____,有_____種不同能級的電子。
(3)R 中 H、N、O 三種元素的電負性由大到小的順序是_____(用元素符號表示)。
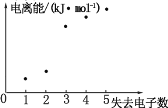
(4)如圖表示短周期元素 X 的基態原子失去電子數與對應電離能的關系,試推測 X 與R 中的_____(填元素符號)元素同周期。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com