
| A. | 堿金屬單質的密度隨著原子序數的增大而增大 | |
| B. | 堿金屬單質都是銀白色金屬 | |
| C. | 在周期表中金屬與非金屬的分界處,可以找到半導體材料 | |
| D. | 所有氣體單質都含有非極性鍵 |
分析 A.堿金屬的密度隨著原子序數的遞增逐漸增大,Na、K反常;
B.Li、Na、K、Rb等堿金屬單質都是銀白色;
C.在周期表中金屬和非金屬分界線處的元素具有金屬性和非金屬性;
D.稀有氣體中不存在化學鍵.
解答 解:A.堿金屬的密度隨著原子序數的遞增逐漸增大,Na、K反常,故A錯誤;
B.Li、Na、K、Rb等堿金屬單質都是銀白色,但Cs具有金屬光澤,故B錯誤;
C.在周期表中金屬和非金屬分界線處的元素具有金屬性和非金屬性,所以可以找到半導體材料,故C正確;
D.稀有氣體是單原子分子,稀有氣體中不存在化學鍵,只存在分子間作用力,故D錯誤;
故選C.
點評 本題考查堿金屬的結構和性質、元素周期表的應用、化學鍵等知識點,側重考查學生分析推斷能力,以堿金屬為例熟練掌握同一主族元素性質遞變規律,易錯選項是D.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:解答題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
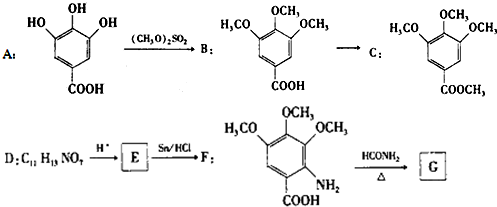
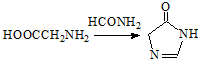
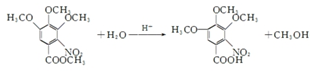 .
.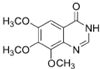 .
.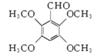 .
.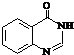 .合成過程中無機試劑任選.
.合成過程中無機試劑任選.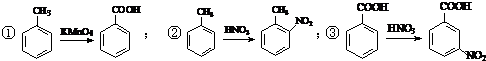 )
)查看答案和解析>>
科目:高中化學 來源: 題型:解答題
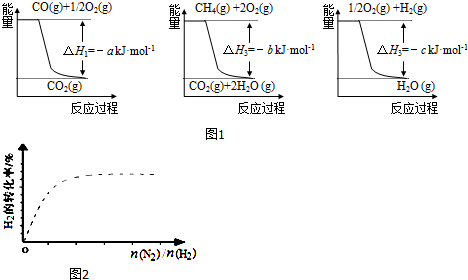
| 容 器 | 甲 | 乙 |
| 反應物投入量 | 3mol H2、2mol N2 | 6mol H2、4mol N2 |
| 達到平衡的時間(min) | t | 5 |
| 平衡時N2的濃度(mol•L-1) | 3 | c |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
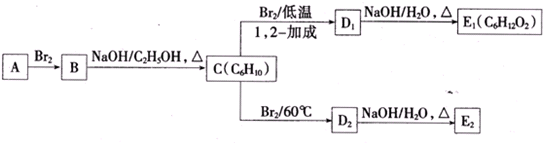
 .
.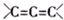 為不穩定結構.
為不穩定結構. .
. .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na2CO3和NaHCO3均可與澄清石灰水反應 | |
| B. | NaHCO3比Na2CO3熱穩定性強 | |
| C. | 相同質量的Na2CO3和NaHCO3與足量鹽酸作用時,產生的氣體質量相同 | |
| D. | Na2CO3俗名小蘇打,NaHCO3俗名純堿,其溶液均顯堿性 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com