
分析 達到平衡時,測得c(H2)=0.08mol/L,則 2HI(g)?H2(g)+I2(g)
起始時各物質的濃度(mol•L-1) 0.2 0 0
各物質的濃度變化量(mol•L-1) 0.16 0.08 0.08
平衡時各物質的濃度(mol•L-1) 0.04 0.08 0.08
(1)利用平衡的濃度計算K,K為生成物濃度冪之積與反應物濃度冪之積的比;
(2)設轉化的碘化氫為x,利用三段法得出各物質的平衡濃度,平衡常數與(1)相同,以此來計算.
解答 解:達到平衡時,測得c(H2)=0.08mol/L,則 2HI(g)?H2(g)+I2(g)
起始時各物質的濃度(mol•L-1) 0.2 0 0
各物質的濃度變化量(mol•L-1) 0.16 0.08 0.08
平衡時各物質的濃度(mol•L-1) 0.04 0.08 0.08
(1)平衡時c(H2)=c(I2)=0.08mol/L,c(HI)=0.04mol/L,
則K=$\frac{0.08×0.08}{0.04{\;}^{2}}$=4,
答:該反應的平衡常數為4;
(2)在上述溫度下,該容器中若充入碘化氫0.4mol,設HI轉化了x
則 2HI(g)?H2(g)+I2(g)
起始時各物質的濃度(mol•L-1) 0.4 0 0
各物質的濃度變化量(mol•L-1) x 0.5x 0.5x
平衡時各物質的濃度(mol•L-1) 0.4-x 0.5x 0.5x
K=$\frac{0.5x×0.5x}{(0.4-x){\;}^{2}}$=4,
解得:x=0.32 mol;
碘化氫轉化率=$\frac{0.32mol}{0.4mol}$×100%=80%
所以平衡時c(H2)=$\frac{0.5×0.32mol}{1L}$=0.16mol/L;
答:平衡時碘化氫的轉化率為80%,氫氣的物質的量濃度為0.16mol/L.
點評 本題考查化學平衡的計算,明確化學平衡的三段法計算格式及平衡常數的計算方法是解答本題的關鍵,注意利用平衡濃度計算平衡常數,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | Na | B. | FeCl3溶液 | C. | KMnO4酸性溶液 | D. | 溴水 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | HCOOH+H2O?HCOO-+H3O+ | B. | CO32-+H2O?HCO3-+OH- | ||
| C. | CO2+H2O?HCO3-+H+ | D. | HS-?S2-+H+ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
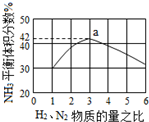 氮是地球上含量豐富的一種元素,氮及其化合物在工農業生產、生活中有著重要作用,氨是最重要的氮肥,是產量最大的化工產品之一.其工業合成原理為:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.在密閉容器中,使2mol N2和6mol H2混合發生以上反應.
氮是地球上含量豐富的一種元素,氮及其化合物在工農業生產、生活中有著重要作用,氨是最重要的氮肥,是產量最大的化工產品之一.其工業合成原理為:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.在密閉容器中,使2mol N2和6mol H2混合發生以上反應.查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
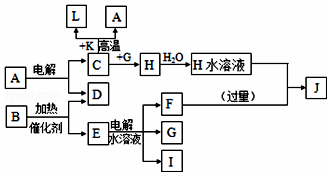 已知C、D、G、I為短周期元素形成的單質,D、G、I常溫下為氣態,且G為黃綠色;形成D的元素原子的最外層電子數是次外層的3倍;B的焰色反應呈紫色(透過藍色鈷玻璃);K為紅棕色粉末.其轉化關系如圖:
已知C、D、G、I為短周期元素形成的單質,D、G、I常溫下為氣態,且G為黃綠色;形成D的元素原子的最外層電子數是次外層的3倍;B的焰色反應呈紫色(透過藍色鈷玻璃);K為紅棕色粉末.其轉化關系如圖: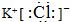
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com