
 .
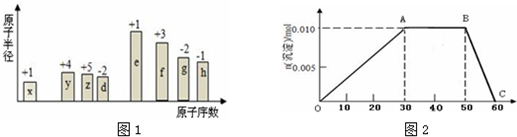
.分析 從圖中的化合價、原子半徑的大小及原子序數,可知x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素.
(1)h為Cl元素,其原子核外有17個電子分三層排布;
(2)①R是(NH4) aAl b(SO4)c,根據Al3+、NH4+消耗的氫氧化鈉計算ab,根據化合價的代數和為零計算c;
②m點過程中加入氫氧化鈉,沉淀物質的量不變,是NH4+與OH-反應生成NH3•H2O.
解答 解:從圖中的化合價、原子半徑的大小及原子序數,可知x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素.
(1)h為Cl元素,其原子核外有17個電子分三層排布,其原子結構示意圖為 ,故答案為:
,故答案為: ;
;
(2)①R是(NH4) aAl b(SO4)c,滴加氫氧化鈉發生反應Al3++3OH-=Al(OH)3↓、NH4++OH-=NH3•H2O,根據消耗的氫氧化鈉可知n(NH4+):n(Al3+)=2:1,當a=4,b=2時,由化合價的代數和為零可知,c=5,所以a:b:c=4:2:5,
故答案為:4:2:5;
②m點過程中加入氫氧化鈉,沉淀物質的量不變,是NH4+與OH-反應生成NH3•H2O,離子方程式為:NH4++OH-=NH3•H2O,
故答案為:NH4++OH-=NH3•H2O.
點評 本題考查結構位置性質關系、化學圖象及化學計算,是對學生綜合能力的考查,需要學生具備扎實的基礎,難度中等,注意把握圖象中各段發生的反應.


科目:高中化學 來源: 題型:選擇題

| A. | 2,2-二甲基戊醇 | B. | 2,2-二甲基-4-戊醇 | ||
| C. | 1,3,3-三甲基丁醇 | D. | 4,4-二甲基-2-戊醇 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 弱酸 | CH3COOH | HCN | H2CO3 |
| 電離平衡常數(25℃) | K1=1.76×10-5 | K1=4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A. | 中和等體積、等pH的CH3COOH溶液和HCN溶液消耗NaOH的量前者大于后者 | |
| B. | 可發生反應:2CH3COOH+CO32-=2CH3COO-+H2O+CO2↑ | |
| C. | Na+、CN-、CH3COO-、HCO3-等離子能大量共存 | |
| D. | 等濃度的CH3COONa和NaCN溶液pH前者小于后者 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 樣品中Fe元素的質量為2.24 g | B. | 濾液A中的陽離子為Fe2+、Fe3+、H+ | ||
| C. | 樣品中CuO的質量為4.0 g | D. | V=896 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ;
;查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Cu(OH)2與H2SO4 | B. | Ba(OH)2與H2SO4 | C. | Fe(OH)3與HCl | D. | HNO3與KOH |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 序號 | 氧化劑 | 還原劑 | 其他反應物 | 氧化產物 | 還原產物 |
| ① | Cl2 | FeBr2 | / | Cl- | |
| ② | KClO3 | 濃鹽酸 | / | Cl2 | |
| ③ | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
| A. | 表中①組反應當n(FeBr2):n(Cl2)≥$\frac{1}{2}$一種元素被氧化、當n(FeBr2):n(Cl2)<$\frac{1}{2}$兩種元素被氧化 | |
| B. | 氧化性強弱的比較:KClO3>Fe3+>Cl2>Br2 | |
| C. | 表中②組反應的還原產物是KCl,電子轉移數目是6e- | |
| D. | 表中③組反應的離子方程式為:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com