
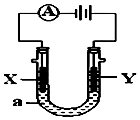
 電解原理在化學工業中有廣泛應用.如圖表示一個電解池,裝有電解液a;X、Y是兩塊電極板,通過導線與直流電源相連.請回答以下問題:
電解原理在化學工業中有廣泛應用.如圖表示一個電解池,裝有電解液a;X、Y是兩塊電極板,通過導線與直流電源相連.請回答以下問題:分析 (1)若X、Y都是惰性電極,a是飽和NaCl溶液,Y電極上氯離子放電生成氯氣,氯氣可以用濕潤的淀粉碘化鉀試紙檢驗,X電極上氫離子放電,同時該電極附近生成氫氧根離子;
(2)若X和Y仍均為惰性電極,a為CuSO 4 溶液,則Y電極上氫氧根離子放電生成氧氣,同時該電極附近生成氫離子,X電極上銅離子離子放電生成銅單質,據此分析判斷;
(3)如要用電解方法精煉粗銅,電解液a選用CuSO4溶液,陽極應該是粗銅、陰極是純銅,則X電極是純銅、Y電極是粗銅,陰極上銅離子放電.
解答 解:(1)①若X、Y都是惰性電極,a是飽和NaCl溶液,Y電極上氯離子放電生成氯氣,電極反應式為2Cl--2e-=Cl2↑,氯氣具有氧化性,能氧化碘離子生成碘單質,碘遇淀粉試液變藍色,所以氯氣可以用濕潤的淀粉碘化鉀試紙檢驗;X電極上氫離子放電,同時該電極附近生成氫氧根離子,所以在X極附近觀察到的現象是有氣泡產生,溶液變紅,
故答案為:2Cl--2e-=Cl2↑;有氣泡產生,溶液變紅;將濕潤的淀粉碘化鉀試紙接近出氣口,如果試紙變藍色就說明生成氯氣;
②X電極上氫離子放電,同時該電極附近生成氫氧根離子,Y電極上氯離子放電生成氯氣,所以電池反應式為2Cl-+2H2O $\frac{\underline{\;電解\;}}{\;}$2OH-+Cl2↑+H2↑,
故答案為:2Cl-+2H2O $\frac{\underline{\;電解\;}}{\;}$2OH-+Cl2↑+H2↑;
(2)若X和Y仍均為惰性電極,a為CuSO4溶液,則電解時的總化學反應方程式為2CuSO4+2H2O$\frac{\underline{\;電解\;}}{\;}$2Cu+O2↑+2H2SO4,通電一段時間后,向所得溶液中加入16gCuO粉末,物質的量=$\frac{16g}{80g/mol}$=0.2mol,恰好恢復到電解前的濃度和pH,則生成的硫酸為0.2mol,反應的硫酸銅物質的量為0.2mol,轉移電子0.4mol,故答案為:2CuSO4+2H2O$\frac{\underline{\;電解\;}}{\;}$2Cu+O2↑+2H2SO4;0.4mol;
(3)如要用電解方法精煉粗銅,電解液a選用CuSO4溶液,陽極應該是粗銅、陰極是純銅,則X電極是純銅、Y電極是粗銅,陰極上銅離子放電,電極反應式為Cu2++2e-=Cu,所以若電路中有0.04摩爾電子通過時,陰極增重$\frac{0.04}{2}$×64=1.28g,故答案為:①純銅;②Cu2++2e-=Cu;③1.28.
點評 本題考查了電解原理的分析應用,主要是電極反應的書寫和電子守恒的計算應用,掌握基礎是關鍵.


 輕松暑假總復習系列答案
輕松暑假總復習系列答案科目:高中化學 來源: 題型:選擇題
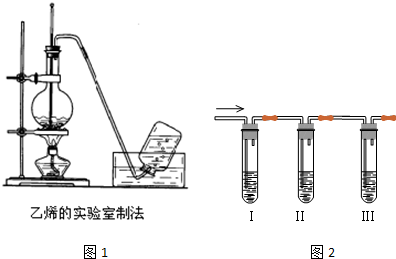
| A. | 制乙烯時,用排水法或向上排空氣法收集氣體 | |
| B. | 制氯氣時,用飽和NaHCO3溶液和濃硫酸凈化氣體 | |
| C. | 制氧氣時,用Na2O2或H2O2作反應物可選擇相同的氣體發生裝置 | |
| D. | 制二氧化氮時,用水或NaOH溶液吸收尾氣 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 Mn、Fe均為第四周期過渡元素,兩元素的部分電離能數據列于表:
Mn、Fe均為第四周期過渡元素,兩元素的部分電離能數據列于表:| 元 素 | Mn | Fe | |
| 電離能 /kJ•mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
 某化學活動小組設計實驗(裝置如圖)驗證氯、溴、碘及其化合物的有關物質.在硬質玻璃管中的A、B、C三處依次放置濕潤的藍色石蕊試紙、浸有NaBr溶液的棉球、浸有淀粉-KI溶液的棉球(如圖所示),由左端通入足量氯氣,回答下列問題:
某化學活動小組設計實驗(裝置如圖)驗證氯、溴、碘及其化合物的有關物質.在硬質玻璃管中的A、B、C三處依次放置濕潤的藍色石蕊試紙、浸有NaBr溶液的棉球、浸有淀粉-KI溶液的棉球(如圖所示),由左端通入足量氯氣,回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 乙烯、苯、環己烷都屬于脂肪烴 | B. | 苯、環戊烷、環己烷同屬于芳香烴 | ||
| C. | 乙烯、乙炔同屬于烯烴 | D. |  、 、 、 、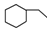 同屬于環烷烴 同屬于環烷烴 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 增大壓強,活化分子數增加,化學反應速率一定增大 | |
| B. | 升高溫度,活化分子百分數增加,化學反應速率一定增大 | |
| C. | 加入反應物,使活化分子百分數增加,化學反應速率增大 | |
| D. | 使用催化劑,降低了反應的活化能、反應速率加快,但是活化分子百分數不變 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com