
 Mn、Fe均為第四周期過渡元素,兩元素的部分電離能數據列于表:
Mn、Fe均為第四周期過渡元素,兩元素的部分電離能數據列于表:| 元 素 | Mn | Fe | |
| 電離能 /kJ•mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
分析 (1)原子軌道處于半滿、全滿、全空時能量更低而更穩定;
(2)①含有空軌道和含有孤電子對的原子之間易形成配位鍵;
②CN-中C原子價層電子對個數是2,且含有一個孤電子對,根據價層電子對互斥理論判斷C原子雜化類型;原子個數相等、價電子數相等的微粒互為等電子體;
(3)分子晶體熔沸點較低;
(4)利用均攤分計算每個晶胞中原子個數.
解答 解:(1)Mn元素為25號元素,核外電子排布式為[Ar]3d54s2,所以價層電子排布式為3d54s2,由Mn2+轉化為Mn3+時,3d能級由較穩定的3d5半充滿狀態轉為不穩定的3d4狀態需要的能量較多;而Fe2+到Fe3+時,3d能級由不穩定的3d6到穩定的3d5半充滿狀態,需要的能量相對要少,
故答案為:3d54s2; Mn2+轉化為Mn3+時,3d能級由較穩定的3d5半充滿狀態轉變為不穩定的3d4狀態(或Fe2+轉化為Fe3+時,3d能級由不穩定的3d6狀態轉變為較穩定的3d5半充滿狀態);
(2)①含有空軌道和含有孤電子對的原子之間易形成配位鍵,Fe原子含有空軌道,則Fe原子能和含有孤電子對的原子易形成配位鍵,故答案為:具有孤對電子;
②sCN-中C原子價層電子對個數是2,且含有一個孤電子對,根據價層電子對互斥理論判斷C原子雜化類型為sp;原子個數相等、價電子數相等的微粒互為等電子體,氫氰根離子中含有2個原子、價電子數是10,與氮氣分子互為等電子體,氮氣分子路易斯結構式為:N≡N:,
故答案為:sp;:N≡N:;
(3)分子晶體熔沸點較低,根據題給信息知,氯化鐵熔沸點較低,應該是分子晶體,故答案為:分子晶體;
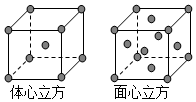
(4)面心面心立方晶胞中Fe原子個數=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,體心立方基晶胞中Fe原子個數=1+8×$\frac{1}{8}$=2,所以面心立方晶胞中Fe原子個數與體心立方晶胞中Fe原子個數之比=4:2=2:1,故答案為:2:1.
點評 本題考查物質結構和性質,涉及晶胞計算、晶體類型判斷、原子雜化方式判斷等知識點,明確物質結構、價層電子對互斥理論等知識點是解本題關鍵,注意路易斯結構式與結構式、電子式的區別,題目難度不大.


 浙江名校名師金卷系列答案
浙江名校名師金卷系列答案 全優沖刺100分系列答案
全優沖刺100分系列答案科目:高中化學 來源: 題型:實驗題
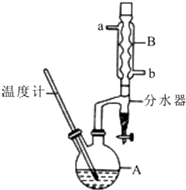 正丁醚常用作有機反應的溶劑.實驗室制備正丁醚的反應和主要實驗裝置如下:2CH3CH2CH2CH2OH$?_{135℃}^{濃硫酸}$(CH3CH2CH2CH2)2O+H2O,反應物和產物的相關數據如表:
正丁醚常用作有機反應的溶劑.實驗室制備正丁醚的反應和主要實驗裝置如下:2CH3CH2CH2CH2OH$?_{135℃}^{濃硫酸}$(CH3CH2CH2CH2)2O+H2O,反應物和產物的相關數據如表:| 相對分子質量 | 沸點/℃ | 密度/(g/cm3) | 水中的溶解性 | |
| 正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
| 正丁醚 | 130 | 142.0 | 0.7704 | 幾乎不容 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 增大壓強 | B. | 升高溫度 | C. | 增大CH4濃度 | D. | 更換高效催化劑 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| t/s | 0 | 500 | 1000 |
| c(N2O5) mol/L | 5.00 | 3.25 | 2.48 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 增大反應體系的壓強,反應速率增大 | |
| B. | 加入碳粉,平衡向右移動,原因是碳與O2反應,降低了生成物的濃度且放出熱量 | |
| C. | 電解熔融的Al2O3和AlCl3均能得到單質鋁 | |
| D. | 升高溫度,反應的平衡常數將增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
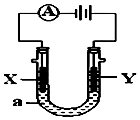 電解原理在化學工業中有廣泛應用.如圖表示一個電解池,裝有電解液a;X、Y是兩塊電極板,通過導線與直流電源相連.請回答以下問題:
電解原理在化學工業中有廣泛應用.如圖表示一個電解池,裝有電解液a;X、Y是兩塊電極板,通過導線與直流電源相連.請回答以下問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | △H1+△H2=△H | |
| B. | I-是H2O2分解反應的催化劑 | |
| C. | 欲分解2 mol H2O2(l),至少需要提供98 kJ的熱量 | |
| D. | 若生成1 mol O2,則反應ii轉移電子的物質的量為2 mol |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com