
分析 (1)由H2A的電離方程式可知H2A為弱酸,CaA水解呈堿性,CaA(s)?Ca2+(aq)+A2-(aq)△H>0為吸熱過程,降溫平衡逆向移動,加入鹽酸,可生成HA-、H2A;
(2)依據濃度計算10L廢水中Cr2O72-的物質的量,結合氧化還原反應電子守恒的定量關系計算硫酸亞鐵晶體質量;結合溶度積常數計算.
解答 解:(1)由H2A的電離方程式可知H2A為弱酸,CaA水解呈堿性,CaA(s)?Ca2+(aq)+A2-(aq)△H>0為吸熱過程,降溫平衡逆向移動,加入鹽酸,可生成HA-、H2A,則促進CaA的溶解,c(Ca2+)增大,
故答案為:堿;減小;增大;
(2)某工廠廢水中含5.00×10-3 mol•L-1的Cr2O72-,n(Cr2O72-)=10L×5.00×10-3mol/L=5.00×10-2mol,
依據氧化還原反應離子方程式:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,得到n(Fe2+)=5.00×10-2mol×6=0.3mol,
需要FeSO4•7H2O蒸餾=0.3mol×278g/mol=83.4g,
若處理后的廢水中殘留的c(Fe3+)=2×10-13mol•L-1,Ksp[Fe(OH)3]=c(Fe3+)c3(OH-)=4.0×10-38,計算得到c3(OH-)=2×10-25mol/L,則殘留的Cr3+的濃度為Ksp[Cr(OH)3]=c(Cr3+)c3(OH-)=6.0×10-31 ,c(Cr3+)=3×10-6mol•L-1,
故答案為:83.4;3×10-6.
點評 本題考查較綜合,涉及難溶物的溶解平衡、氧化還原反應的計算等知識點,難度較大,根據溫度、電解質溶液對難溶物性質的影響和守恒的角度解答即可.


科目:高中化學 來源: 題型:解答題
| 元素編號 元素性質 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 原子半徑 (10-10m) | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
| 最高價態 | +1 | +1 | -- | +3 | +4 | +5 | +7 | +1 | +5 | -- |
| 最低價態 | -- | -- | -2 | -- | -4 | -3 | -1 | -- | -3 | -1 |
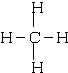 ;③和⑤形成的化合物的電子式
;③和⑤形成的化合物的電子式 ;寫出元素③和⑧形成的既有離子鍵,又有共價鍵的化合物的電子式
;寫出元素③和⑧形成的既有離子鍵,又有共價鍵的化合物的電子式 ;
;查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 化學鍵 | C-C | O=O | C=O |
| 鍵能(kJ/mol) | 348 | 498 | x |
| A. | X=794.5 | |
| B. | X=1142.5 | |
| C. | 1mol金剛石的能量一定比1molCO2能量高 | |
| D. | 金剛石燃燒的熱化學方程式為2C(s)+O2(g)=2CO(g)△H=790kJ/mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 加熱蒸餾 | |
| B. | 加入Na2CO3后,通過萃取的方法分離 | |
| C. | 先加入燒堿溶液,之后蒸出乙醛,再加入濃H2SO4,蒸出乙酸 | |
| D. | 和Na反應后進行分離 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | c (Ba2+)=c(SO42-)=(Ksp)${\;}^{\frac{1}{2}}$ | B. | c(Ba2+)•c(SO42-)>Ksp,c(Ba2+)=c(SO42-) | ||
| C. | c(Ba2+)•c(SO42-)=Ksp,c(Ba2+)>c(SO42-) | D. | c(Ba2+)•c(SO42-)≠Ksp,c(Ba2+)<c(SO42-) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
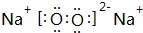 、
、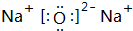 .
. .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 140 mL | B. | 120 mL | C. | 100 mL | D. | 80 mL |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氨基酸、多肽、蛋白質都具有兩性 | |
| B. | 利用油脂在酸性條件下水解,可以產生甘油和肥皂 | |
| C. | 淀粉與纖維素分子式都為(C6H10O5)n,但結構不同,所以它們互為同分異構體 | |
| D. | 飽和Na2SO4、CuSO4溶液均可用于蛋白質的鹽析 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com