
 工業上合成合成氨的熱化學方程式如下:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
工業上合成合成氨的熱化學方程式如下:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol分析 (1)根據平衡常數的概念寫出該反應的化學平衡常數表達式;
(2)有化學平衡移動的可以用勒夏特列原理解釋,
A.加入催化劑平衡不移動,不能用勒夏特列原理解釋;
B.合成氨的反應正向為氣體體積減小的反應,增大反應容器的壓強(50MPa),平衡正向移動;
C.合成氨的反應為放熱反應,升高反應的溫度(5000C) 平衡逆向移動,反應物的轉化率減小,不能用勒夏特列原理解釋;
D.設法分離產生的氨氣平衡正向移動,能用勒夏特列原理解釋;
(3)①根據公式v=$\frac{△c}{△t}$計算;
②若容器為體積可變的恒壓容器,在4min時往容器中再加入N2和H2各1mol,反應物的濃度增大,生成物的濃度減小,平衡向右移動,溫度未發生變化,平衡常數不變;根據等效平衡知識,反應一段時間后,在t min時再次達到平衡時H2的物質的量為原平衡的2倍.
解答 解:(1)反應N2(g)+3H2(g)?2NH3(g)的平衡常數表達式為:K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$,
故答案為:K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$;
(2)A.加入催化劑平衡不移動,不能用勒夏特列原理解釋,故A錯誤;
B.合成氨的反應正向為氣體體積減小的反應,增大反應容器的壓強(50MPa),平衡正向移動,能用勒夏特列原理解釋,故B正確;
C.合成氨的反應為放熱反應,升高反應的溫度(5000C) 平衡逆向移動,反應物的轉化率減小,不能用勒夏特列原理解釋,故C錯誤;
D.設法分離產生的氨氣,生成物濃度減小,平衡正向移動,能用勒夏特列原理解釋,故D正確;
故答案為:BD;
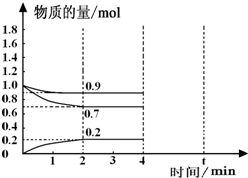
(3)①根據公式v=△n/V△t計算;根據圖象可知,反應開始2分鐘 NH3的物質的量變化為0.2mol,容器的體積為2L,則反應速率v=$\frac{\frac{0.2mol}{2L}}{2min}$=0.05mol/(L•min),
故答案為:0.05mol/(L•min);
②若容器為體積可變的恒壓容器,在4min時往容器中再加入N2和H2各1mol,反應物的濃度增大,生成物的濃度減小,平衡向右移動,溫度未發生變化,平衡常數不變,
故答案為:向右;不變;
(4)根據等效平衡知識,反應一段時間后,在t min時再次達到平衡時H2的物質的量為原平衡的2倍.H2在4min-t min時間內物質的量的變化曲線為: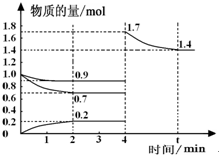 ,
,
故答案為: .
.
點評 本題考查化學平衡的計算,題目難度中等,涉及化學反應速率和化學平衡的計算及圖象,旨在考查學生對基礎知識的理解掌握,明確化學平衡及其影響為解答關鍵,試題培養了學生的分析能力及靈活應用能力.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:選擇題
| A. | 在混合物中加入足量濃硫酸,加熱、過濾 | |
| B. | 在混合物中加入足量NaOH溶液,過濾 | |
| C. | 用磁石將鐵粉吸出 | |
| D. | 在混合物中加入足量濃硝酸,加熱、過濾 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑ | B. | Fe+CuSO4═FeSO4+Cu | ||
| C. | 2H2O $\frac{\underline{\;通電\;}}{\;}$ 2H2↑+O2↑ | D. | Cl2+2NaOH═NaCl+NaClO+H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 某氣體能使品紅溶液褪色,則該氣體是SO2 | |
| B. | 向某溶液中加入AgNO3溶液,產生白色沉淀,則原溶液中有Cl- | |
| C. | 某溶液中加入稀鹽酸,不產生白色沉淀,再加入BaCl2溶液,產生白色沉淀,原溶液中有SO42- | |
| D. | 某溶液中加入鹽酸產生無色氣體,且該氣體能使澄清石灰水變渾濁,則原溶液中一定含有CO32-或者HCO3- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
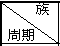 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅦA | ⅧA | O |
2 | N | O | F | |||||
3 | Na | Mg | Al | S | Cl | Ar | ||
4 | K |
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 14 | B. | 28 | C. | 31 | D. | 35.5 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
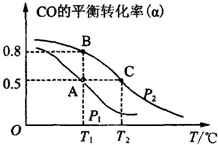 (1)已知:3H2(g)+3CO(g)═CH3OCH3(g)+CO2(g),△H=-247kJ/mol.一定條件下的密閉容器中,該總反應達到平衡,要提高CO的轉化率,可以采取的措施是AE.
(1)已知:3H2(g)+3CO(g)═CH3OCH3(g)+CO2(g),△H=-247kJ/mol.一定條件下的密閉容器中,該總反應達到平衡,要提高CO的轉化率,可以采取的措施是AE.| 物質 | CH3OH | CH3OCH3 | H2O |
| 濃度/(mol•L-1) | 0.01 | 0.2 | 0.2 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com