
 (1)已知:3H2(g)+3CO(g)═CH3OCH3(g)+CO2(g),△H=-247kJ/mol.一定條件下的密閉容器中,該總反應達到平衡,要提高CO的轉化率,可以采取的措施是AE.
(1)已知:3H2(g)+3CO(g)═CH3OCH3(g)+CO2(g),△H=-247kJ/mol.一定條件下的密閉容器中,該總反應達到平衡,要提高CO的轉化率,可以采取的措施是AE.| 物質 | CH3OH | CH3OCH3 | H2O |
| 濃度/(mol•L-1) | 0.01 | 0.2 | 0.2 |
分析 (1)要提高CO的轉化率,應使平衡向正反應分析移動;
(2)2CH3OH(g)═CH3OCH3(g)+H2O(g)
①K等于生成物濃度冪之積與反應物濃度冪之積的比,結合平衡濃度計算;
②計算二甲醚的反應速率,結合反應速率之比等于化學計量數之比計算v(CH3OH),依據濃度商和平衡常數比較判斷反應進行的方向;
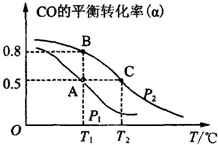
(3)①化學平衡圖象分析方法,平衡圖象題主要注意三點一趨勢,三點是:圖象的起點、拐點、終點,一趨勢是看曲線的變化趨勢.當然要看好橫、縱坐標的向量.
②對于一個給定的化學反應,化學平衡常數的影響因素只有溫度;
③燃料電池的正極電極反應式書寫,只有兩種寫法:
酸性:O2+4e-+4H+=2H2O
堿性:O2+4e-+2H2O=4OH-
解答 解:(1)A.正反應放熱,則降低溫度可使平衡向正方向移動,增大壓強平衡向正方向移動,CO的轉化率增大,故A正確;
B.加入催化劑平衡不移動,故B錯誤;
C.體積不變充入N2,平衡不移動,故C錯誤;
D.增加CO濃度,CO的轉化率降低,故D錯誤;
E.分離出二甲醚,可使平衡向正方向移動,CO的轉化率增大故E正確,
故答案為:AE;
(2)①由表格中的數據及K的定義可知,2CH3OH(g)═CH3OCH3(g)+H2O(g)
反應的平衡常數K=$\frac{c(C{H}_{3}OC{H}_{3})c({H}_{2}O)}{{c}^{2}(C{H}_{3}OH)}$=$\frac{0.2×0.2}{0.0{1}^{2}}$=400,
故答案為:$\frac{c(C{H}_{3}OC{H}_{3})c({H}_{2}O)}{{c}^{2}(C{H}_{3}OH)}$,400;
②由表格中的數據可知,v(CH3OCH3)=$\frac{0.2mol/L}{10min}$=0.02 mol•L-1•min-1,又反應速率之比等于化學計量數之比,
v(CH3OH)=2×0.02 mol•L-1•min-1=0.04 mol•L-1•min-1;
若平衡后,再向容器中再加入0.01mol CH3OH和0.2mol CH3OCH3,c(CH3OH)=0.02mol/L,c(CH3OCH3)=0.4mol/L c(H2)=0.2mol/L
Q=$\frac{0.2×0.4}{0.0{2}^{2}}$=200<K,說明平衡正向進行,v正>v逆;
故答案為:0.04 mol•L-1•min-1;>;
(3)①從圖上可見,在P2時,隨溫度的升高CO的轉化率越來越低,可見,升溫時平衡向逆向移動,據勒夏特列原理,正反應放熱.
故答案為:放熱
②化學平衡常數只受溫度的影響,該反應放熱,溫度越高平衡逆向移動,K值減小.
故答案為:KA=KB>KC;
③燃料電池的正極,是氧氣反應,在堿性條件下有水參與生成氫氧根.O2+2H2O+4e-=4OH-,
故答案為:O2+2H2O+4e-=4OH-.
點評 本題考查較綜合,主要是平衡常數、化學平衡圖象及平衡移動影響因素、原電池電極反應書寫等,側重分析能力、計算能力及知識遷移應用能力的考查,綜合性較強,題目難度中等.


科目:高中化學 來源: 題型:解答題
 工業上合成合成氨的熱化學方程式如下:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
工業上合成合成氨的熱化學方程式如下:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| 選項 | 甲 | 乙 | 丙 | 試管中現象 |
| A | 濃氨水 | 生石灰 | Al(SO4)3溶液 | 先沉淀后消失 |
| B | 濃硝酸 | 銅 | 淀粉KI溶液 | 試管口出現紅棕色溶液仍為無色 |
| C | 濃鹽酸 | 二氧化錳 | 石蕊溶液 | 先變紅后褪色 |
| D | 雙氧水 | 二氧化錳 | 氫硫酸 | 溶液出現渾濁 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 具有氧化性的物質在反應中一定做氧化劑 | |
| B. | 氧化還原反應的實質是電子轉移 | |
| C. | 某元素從游離態變為化合態,該元素一定被氧化 | |
| D. | 反應中當有一種元素被氧化時,一定有另一種元素被還原 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 明礬在水中形成的Al(OH)3膠體能吸附水中懸浮物,可用于水的凈化 | |
| B. | 氧化鋁常被用于制作作耐火材料 | |
| C. | Fe2O3俗稱鐵紅,常用作紅色的油漆和涂料 | |
| D. | Na2O2具有強氧化性,不能用作呼吸面具中的供氧劑 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
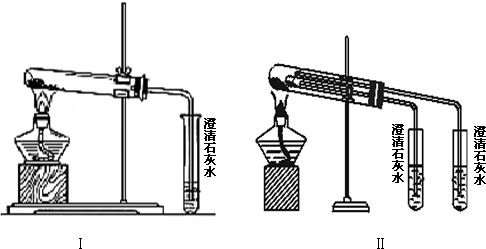
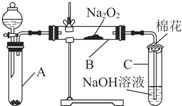 為了探究SO2與Na2O2的反應是否類似于CO2與Na2O2的反應,甲同學設計了如圖所示的實驗裝置,回答下列問題:
為了探究SO2與Na2O2的反應是否類似于CO2與Na2O2的反應,甲同學設計了如圖所示的實驗裝置,回答下列問題:| 實驗步驟 | 預期現象和結論 |
| 步驟1:取B中的少量固體樣品于試管中,滴加足量蒸餾水,溶解,然后取少量待測液分別置于Ⅰ、Ⅱ試管中 | 固體完全溶解 |
| 步驟2:往Ⅰ試管中加入1mol•L-1鹽酸,再滴加1mol•L-1BaCl2溶液 | 有白色沉淀生成,則證明生成物中含Na2SO4, |
| 則證明生成物中含Na2SO4 | |
| 步驟3:往Ⅱ試管中加入2~3滴0.01mol•L-1KMnO4酸性溶液, | |
| 振蕩 | 若KMnO4溶液紫紅色褪去,則證明生成物中有Na2SO3;, |
| 則證明生成物中有Na2SO3;若 | |
| 若KMnO4溶液紫紅色不褪去, | |
| 則說明生成物中沒有Na2SO3. |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com