
【題目】從經濟效益和環境保護考慮,大量制取硝酸銅最宜采用的方法是( )
A.Cu+HNO3(濃)→Cu(NO3)2
B.Cu+HNO3(稀)→Cu(NO3)2
C.Cu![]() CuO
CuO![]() Cu(NO3)2
Cu(NO3)2
D.Cu+AgNO3→Cu(NO3)2
 黃岡天天練口算題卡系列答案
黃岡天天練口算題卡系列答案科目:高中化學 來源: 題型:
【題目】阿托酸甲酯是一種治療腸道疾病的藥物,是由阿托酸(![]() )和甲醇反應制得,完成下列填空:
)和甲醇反應制得,完成下列填空:
(1)寫出阿托酸甲酯的結構簡式:________。
(2)A是比![]() 多兩個碳原子且苯環上只有一個取代基的一種同系物,且A的所有碳原子可以處于同一平面上,寫出A的結構簡式____________。
多兩個碳原子且苯環上只有一個取代基的一種同系物,且A的所有碳原子可以處于同一平面上,寫出A的結構簡式____________。
(3)![]() 是阿托酸甲酯的某種同分異構體的一氯代物,其與足量氫氧化鈉溶液共熱,生成的有機產物的結構簡式為_____________、_______________。
是阿托酸甲酯的某種同分異構體的一氯代物,其與足量氫氧化鈉溶液共熱,生成的有機產物的結構簡式為_____________、_______________。
(4)工業上由![]() 經過四步不同類型的反應制得阿托酸。
經過四步不同類型的反應制得阿托酸。
①請按實際進行的反應順序寫出指定反應步驟中所需要的試劑和反應條件:
第一步_________________;第二步________________。
②寫出第四步反應的化學方程式:________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫及其化合物有許多用途,相關物質的物理常數如下表所示:
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
熔點/℃ | 85.5 | 115.2 | >600(分解) | 75.5 | 16.8 | 10.3 |
沸點/℃ | 60.3 | 444.6 | 10.0 | 45.0 | 337.0 |
回答下列問題:
(1)基態O原子的電子排布圖為_______,基態O原子電子占據最高能級的電子云輪廓圖為____形,O原子最外層電子的運動狀態有_____種。
(2)下圖為S8的結構,該分子中S原子的雜化軌道類型為______________。其熔點和沸點要比二氧化硫的熔點和沸點高很多,主要原因為_____________。
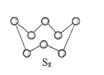
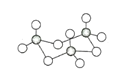
(3)氣態三氧化硫以單分子形式存在,其分子的立體構型為_____形;固體三氧化硫中存在如下圖所示的三聚分子,該分子中S原子的價層電子數___________。
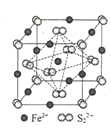
(4)FeS2晶體的晶胞如圖所示。晶胞中有Fe2+_____個,有S22-_____個,晶胞中Fe2+位于S22-所形成的____(填空隙名稱)的體心。晶胞邊長為a nm、FeS2相對分子質量為M,阿伏加德羅常數的值為NA,其晶體密度的計算表達式為___________gcm﹣3。
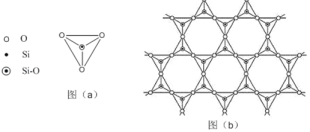
(5)在硅酸鹽中,SiO44﹣四面體(如下圖(a)通過共用頂角氧離子可形成島狀、鏈狀、層狀、骨架網狀四大類結構型式。圖(b)為一種無限長層狀結構的多硅酸根;其中Si原子的雜化形式為____。該多硅酸根的化學式為_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用如圖所示裝置進行以下實驗,能得到相應實驗結論的是
① | ② | ③ | 實驗結論 |
| |
A | 濃氨水 | NaOH | 酚酞 | NaOH的堿性比 NH3H2O的強 | |
B | 濃鹽酸 | MnO2 | 淀粉溶液 | 非金屬性:氯元素大于碘元素 | |
C | 濃硝酸 | Na2CO3 | Na2SiO3 | 酸性:HNO3 > H2CO3 > H2SiO3 | |
D | 濃硫酸 | 蔗糖 | 溴水 | 濃硫酸具有脫水性、氧化性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋁是重要的金屬材料,鋁土礦(主要成分是Al2O3和少量的SiO2、Fe2O3雜質)是工業上制取鋁的原料。實驗室模擬工業上以鋁土礦為原料制銨明礬晶體的工藝流程如圖所示:
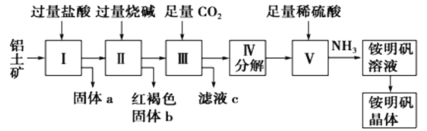
請回答下列問題:
(1)固體a的化學式為___,固體b化學式為___,Ⅲ中通入足量CO2氣體發生反應的離子方程式為___。
(2)由Ⅴ制取銨明礬溶液的化學方程式為___。
(3)由I→II→III→IV都要用到的分離方法是___,由銨明礬溶液中制銨明礬晶體的操作是___,___,過濾,洗滌,干燥保存。
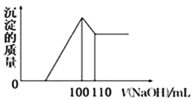
(4)向10gFe2O3、SiO2和Al2O3的混合物中,加入100mL稀硫酸,過濾后,向濾液中加入10mol/LNaOH溶液,產生沉淀的質量和加入NaOH溶液體積的關系曲線如圖所示。則混合物中三氧化二鋁的質量分數為___。
(5)有一種含鐵、硅等元素的礦石,其主要成分的化學式為Na2Fe5(OH)2Si8O22,該物質中+2價鐵與+3價鐵的物質的量之比為___。將mg該礦石用足量的酸溶解后,加入過量銅粉使溶液中的鐵元素全部變為Fe2+,過濾后濾液用cmol/L的KMnO4酸性溶液與Fe2+反應,用去VmL溶液。該礦石中鐵元素的質量分數為___(用含m、c、V的代數式表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)在短周期元素中:
①元素周期表IA族中金屬性最強的元素(符號)是____,與水反應最劇烈的VIIA族中的非金屬元素的(符號)是___;
②原子核外電子總數是其最外層電子數2倍的元素名稱是__,最外層電子數為電子層2倍的元素名稱有____。
(2)已知某主族元素的原子結構示意圖如圖,Y在周期表的位置為___。

(3)A2-原子核內有x個中子,其質量數為m,則ngA2-所含電子的物質的量為__。
(4)X、Y、Z均為短周期元素,它們在周期表中的相對位置如圖所示。
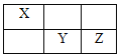
已知X、Y、Z三元素的原子序數之和為40,回答下列問題:
①Z元素的原子結構示意圖為___。
②與Y同主族的下一周期元素的原子序數是___。
③X的氣態氫化物與Y的最高價氧化物對應水化物發生的化學反應方程式___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋅是一種常用金屬,工業上利用鋅焙砂(主要含ZnO、ZnFe2O4,還含有少量CaO、FeO、CuO、NiO 等)濕法制取金屬鋅的流程如圖所示,回答下列問題。

已知:Fe的活潑性強于Ni。
(1)ZnFe2O4可寫成ZnOFe2O3,則ZnFe2O4與H2SO4反應的化學方程式___。
(2)“凈化Ⅰ”操作分為兩步:
①將溶液中少量的 Fe2+氧化,下列試劑中可選用的是_____(填字母標號)。
A.新制氯水 B.30 % H2O2溶液 C.FeC13溶液 D.KMnO4溶液
②加入ZnO,調節溶液pH為3.3~6.7;加熱到60℃左右并不斷攪拌,加熱攪拌主要目的是___。
(3)“凈化Ⅰ”生成的沉淀中還含有溶液中的懸浮雜質,溶液中的懸浮雜質被共同沉淀的原因是____。
(4)“凈化Ⅱ”中加入過量Zn的目的是______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關電解質溶液的說法正確的是
A. 向0.1 molL-1CH3COOH溶液中加入少量水,溶液中c(H+)/c(CH3COOH)減小
B. 用惰性電極電解MgCl2溶液,電解的離子方程式為: 2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
C. 向鹽酸中加入氨水至中性,溶液中c(NH4+)/c(Cl-)>1
D. 將AgCl與AgBr的飽和溶液等體積混合,再加入足量AgNO3溶液,生成的沉淀AgCl多
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是一種可充電的鋰離子電池充放電的工作示意圖。放電時該電池的電極反應式為:負極:LixC6-xe-=C6+xLi+(LixC6表示鋰原子嵌入石墨形成的復合材料)正極:Li1-xMnO2+xLi++xe-=LiMnO2(LiMnO2表示含鋰原子的二氧化錳)下列有關說法不正確的是( )
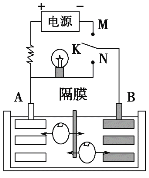
A. 該電池的放電的反應式為Li1-xMnO2+LixC6=LiMnO2+C6
B. K與M相接時,A是陽極,發生氧化反應
C. K與N相接時,Li+由A極區遷移到B極區
D. 在整個充、放電過程中至少存在3種形式的能量轉化
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com