
【題目】阿托酸甲酯是一種治療腸道疾病的藥物,是由阿托酸(![]() )和甲醇反應制得,完成下列填空:
)和甲醇反應制得,完成下列填空:
(1)寫出阿托酸甲酯的結構簡式:________。
(2)A是比![]() 多兩個碳原子且苯環上只有一個取代基的一種同系物,且A的所有碳原子可以處于同一平面上,寫出A的結構簡式____________。
多兩個碳原子且苯環上只有一個取代基的一種同系物,且A的所有碳原子可以處于同一平面上,寫出A的結構簡式____________。
(3)![]() 是阿托酸甲酯的某種同分異構體的一氯代物,其與足量氫氧化鈉溶液共熱,生成的有機產物的結構簡式為_____________、_______________。
是阿托酸甲酯的某種同分異構體的一氯代物,其與足量氫氧化鈉溶液共熱,生成的有機產物的結構簡式為_____________、_______________。
(4)工業上由![]() 經過四步不同類型的反應制得阿托酸。
經過四步不同類型的反應制得阿托酸。
①請按實際進行的反應順序寫出指定反應步驟中所需要的試劑和反應條件:
第一步_________________;第二步________________。
②寫出第四步反應的化學方程式:________________。
【答案】![]()
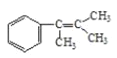
![]() CH2=CH-COONa 溴水或溴的四氯化碳溶液 氫氧化鈉水溶液、加熱
CH2=CH-COONa 溴水或溴的四氯化碳溶液 氫氧化鈉水溶液、加熱 
![]()
![]() +H2O
+H2O
【解析】
(1)阿托酸與甲醇發生酯化反應生成阿托酸甲酯,據此書寫阿托酸甲酯的結構簡式;(2)A是比![]() 多兩個碳原子且苯環上只有一個取代基的一種同系物,則A中有苯環和碳碳雙鍵且有11個碳原子,苯環上所有原子、碳碳雙鍵上所有原子都可以共面,單鍵可以轉動,據此可寫出所有碳原子可以處于同一平面上的A的結構簡式;
多兩個碳原子且苯環上只有一個取代基的一種同系物,則A中有苯環和碳碳雙鍵且有11個碳原子,苯環上所有原子、碳碳雙鍵上所有原子都可以共面,單鍵可以轉動,據此可寫出所有碳原子可以處于同一平面上的A的結構簡式;
(3)![]() 與足量氫氧化鈉溶液共熱,氯原子可被取代生成醇,同時酯基可以水解生成的酚羥基也可與氫氧化鈉反應,據此書寫生成物的結構簡式;
與足量氫氧化鈉溶液共熱,氯原子可被取代生成醇,同時酯基可以水解生成的酚羥基也可與氫氧化鈉反應,據此書寫生成物的結構簡式;
(4)工業上通過![]() 與溴發生加成反應生成
與溴發生加成反應生成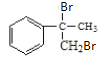 ,
, 再堿性水解得
再堿性水解得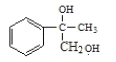 ,
, 氧化得
氧化得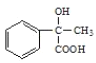 ,
, 再發生醇的消去反應得
再發生醇的消去反應得![]() ,據此分析解答。
,據此分析解答。
(1)阿托酸(![]() )與甲醇發生酯化反應生成阿托酸甲酯,阿托酸甲酯的結構簡式為
)與甲醇發生酯化反應生成阿托酸甲酯,阿托酸甲酯的結構簡式為![]() ,故答案為:
,故答案為:![]() ;
;
(2)A是比![]() 多兩個碳原子且苯環上只有一個取代基的一種同系物,則A中有苯環和碳碳雙鍵且有11個碳原子,苯環上所有原子、碳碳雙鍵上所有原子都可以共面,單鍵可以轉動,所以所有碳原子可以處于同一平面上的A的結構簡式為
多兩個碳原子且苯環上只有一個取代基的一種同系物,則A中有苯環和碳碳雙鍵且有11個碳原子,苯環上所有原子、碳碳雙鍵上所有原子都可以共面,單鍵可以轉動,所以所有碳原子可以處于同一平面上的A的結構簡式為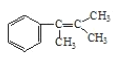 ,故答案為:
,故答案為: ;
;
(3)![]() 與足量氫氧化鈉溶液共熱,氯原子可被取代生成醇,同時酯基可以水解生成的酚羥基也可與氫氧化鈉反應,所以生成的有機物的結構簡式為
與足量氫氧化鈉溶液共熱,氯原子可被取代生成醇,同時酯基可以水解生成的酚羥基也可與氫氧化鈉反應,所以生成的有機物的結構簡式為![]() 、CH2=CH-COONa,故答案為:
、CH2=CH-COONa,故答案為:![]() 、CH2=CH-COONa;
、CH2=CH-COONa;
(4)工業上通過![]() 與溴發生加成反應生成
與溴發生加成反應生成 ,
, 再堿性水解得
再堿性水解得 ,
, 氧化得
氧化得 ,
, 再發生羥基的消去反應得
再發生羥基的消去反應得![]() 。
。
①根據上面的分析可知,請按實際進行的反應順序寫出指定反應步驟中所需要的試劑和反應條件:第一步為加成反應,所以所需要的試劑和反應條件為溴水或溴的四氯化碳溶液,第二步為鹵代烴的堿性水解,所以所需要的試劑和反應條件為氫氧化鈉水溶液、加熱,故答案為:溴水或溴的四氯化碳溶液;氫氧化鈉水溶液、加熱;
②根據上面的分析可知,第四步反應為 的消去反應,反應的化學方程式為
的消去反應,反應的化學方程式為
![]()
![]() +H2O,故答案為:
+H2O,故答案為:
![]()
![]() +H2O。
+H2O。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】已知V是元素周期表中原子半徑最小的原子。而W、X、Y、Z是四種常見的短周期元素,其原子半徑隨原子序數變化如圖所示。X 和 Ne 的核外電子數相差1,且 X和W能形成化合物X2W; 在Z所在的周期中,Z 元素的最高價氧化物的水化物酸性最強;四種元素的最外層電子數之和為18。 請回答下列問題:
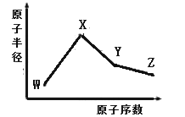
(1) Y元素位于元素周期表中位置為____________。
(2)已知U原子與V是同主族的短周期的元素,單核U、V離子具有相同的電子層結構,其離子的半徑大小是:____________(寫離子符號)
(3) Z的同族簡單氫化物中,沸點最高的是________(寫化學式),原因_______________________。
(4) W、X、Z 三種元素形成具有漂白性的化合物的電子式為___________;W的兩種氫化物結構式分別為____________,______________。
(5) Y與Z形成的化合物YZ4在常溫下是一種液態,它和足量水反應,生成一種弱酸和一種強酸,該反應的化學方程式為__________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】ClO2和NaClO2均具有漂白性,工業上用ClO2氣體制NaClO2的工藝流程如圖所示。
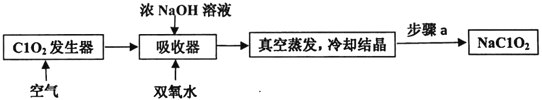
下列說法不正確的是
A. 步驟a的操作包括過濾、洗滌和干燥
B. 吸收器中生成NaClO2的離子方程式:2ClO2+H2O2=2C1O2-+O2↑+2H+
C. 工業上可將ClO2制成NaClO2固體,便于貯存和運輸
D. 通入空氣的目的是驅趕出ClO2,使其被吸收器充分吸收
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學是一門實驗為基礎的科學。請回答下列問題:
(1)利用如圖裝置可驗證濃、稀硝酸氧化性強弱,請完成 實驗操作,回答相關問題:
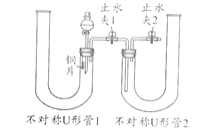
①實驗操作過程:固定銅片,打開分液漏斗活塞及止水夾2,從不對稱U形管1、2長管口處分別注入稀硝酸、濃硝酸,液面與雙孔橡皮塞接觸,然后,關閉分液漏斗玻璃活塞、止水夾1、2。此后可觀察到現象______;然后打開止水夾1,會發現不對稱U形管2中長導管口無色氣泡變紅棕色,濃硝酸逐漸變黃(說明稀硝酸不能氧化這種無色氣體而濃硝酸可以)。
②請用一個化學方程式體現該實驗驗證濃、稀硝酸氧化性強弱的原理_________。
(2)利用如圖裝置可以驗證非金屬性的變化規律。
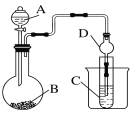
①干燥管D的作用是__________。
②實驗室中現有藥品Na2S、KMnO4、濃鹽酸、MnO2,請選擇合適藥品設計實驗驗證氯的非金屬性大于硫:裝置A、B中所裝藥品分別為________、________,裝置C中的實驗現象為有淡黃色沉淀生成,離子方程式為______________________。
③若要證明非金屬性:Cl > C >Si,則A中加入試劑____________、B中加Na2CO3、C中加入試劑______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法不正確的有幾個()
①質子數相同的微粒一定屬于同一種元素
②同一元素的核素種數由中子數決定
③18gH2O中含有的中子數為10NA
④標準狀況下,等體積CH4和HF所含的分子數相同
⑤通過化學變化可以實現![]() 與
與![]() 之間的相互轉化
之間的相互轉化
A.2個B.3個C.4個D.5個
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】元素周期表中的四種元素的有關信息如下,請用合理的化學用語填寫空白。
在周期表中的區域 | 元素代號 | 有關信息 |
短周期元素 | X | X的最高價氧化物的水化物甲是一種胃酸中和劑,且能溶于強堿溶液 |
Y | Y的一種氫化物可用于制造純堿和做制冷劑 | |
長周期元素 | Z | Z的一種鹽乙可以做凈水劑, |
W | W元素大量存在于海藻中,它的銀鹽可用于人工降雨 |
(1)X元素周期表中的位置為_____,X、Y、W三種元素的簡單離子半徑從大到小的順序為_______。
(2)足量W的最高價氧化物的水化物的稀溶液與1mol甲完全反應,放出熱量QkJ,請寫出表示該過程中和熱的熱化學方程式_____。
(3)下列有關W的氣態氫化物丁的說法正確的有_______(選填字母)
a、丁比氯化氫沸點高 b、丁比氯化氫穩定性好
c、丁比氟化氫還原性弱 d、丁比氟化氫酸性弱
(4)請寫出丙溶于丁的水溶液的離子方程式____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于晶體的說法中,正確的有( )
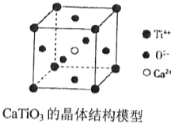
(圖中Ca2+、O2-、Ti4+分別位于立方體的體心、面心和頂點)
①分子晶體中都存在共價鍵②在晶體中只要有陽離子就一定有陰離子③銫、鉀、鈉、鈉-鉀合金的熔點依次降低④離子晶體中只有離子鍵沒有共價鍵,分子晶體中肯定沒有離子鍵⑤CaTiO3晶體中(晶胞結構如上圖所示)每個Ti4+和12個O2-相緊鄰⑥12g石墨中含有的C-C鍵的個數為1.5NA(NA為阿伏加德羅常數)⑦晶體中分子間作用力越大,分子越穩定⑧離子晶體CaO的晶格能比KCl高,熔點KCl比CaO低
A. 2種B. 3種C. 4種D. 5種
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】元素周期表是打開物質世界奧秘之門的一把金鑰匙 ,1869年,門捷列夫發現了元素周期律并發表了元素周期表。下圖為元素周期表的一部分,回答下列問題。
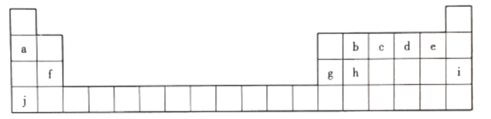
(1).上述元素中化學性質最穩定的是________(填元素符號,下同) ,非金屬性最強的是_____。
(2)c的最高價氧化物對應水化物的化學式為__________。
(3)h元素的原子結構示意圖為__________,寫出h單質的一種用途:__________。
(4)b、d、f三種元素原子半徑由大到小的順序是__________(用元素符號表示)。
(5)a、g、j的氫氧化物中堿性最強的是__________(填化學式),寫出其溶液與g的氧化物反應的離子方程式:___________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】從經濟效益和環境保護考慮,大量制取硝酸銅最宜采用的方法是( )
A.Cu+HNO3(濃)→Cu(NO3)2
B.Cu+HNO3(稀)→Cu(NO3)2
C.Cu![]() CuO
CuO![]() Cu(NO3)2
Cu(NO3)2
D.Cu+AgNO3→Cu(NO3)2
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com