
【題目】下列各組物質分類正確的是( )
酸 | 堿 | 鹽 | 氧化物 | |
A | 硫酸 | 純堿 | 硫酸鈣 | 氧化鐵 |
B | 鹽酸 | 燒堿 | 純堿 | 氧化鈣 |
C | 碳酸 | 硫酸鈣 | 碳酸鈉 | 干冰 |
D | 干冰 | 苛性鈉 | 食鹽 | 石灰石 |
A.A
B.B
C.C
D.D
 提分百分百檢測卷系列答案
提分百分百檢測卷系列答案 寶貝計劃期末沖刺奪100分系列答案
寶貝計劃期末沖刺奪100分系列答案 能考試全能100分系列答案
能考試全能100分系列答案科目:高中化學 來源: 題型:
【題目】某研究小組按下列合成路線合成鎮痛藥芬太尼:
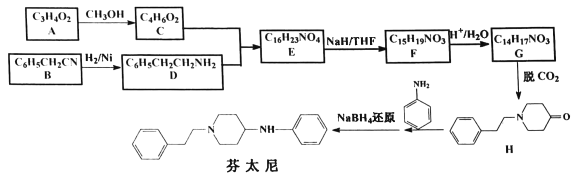
已知:![]()
請回答:
(1)化合物C的結構簡式是________。
(2)下列說法正確的是_________。
A.B→D的反應類型為加成反應
B.F和G都能與碳酸氫鈉溶液反應
C.芬太尼的分子式為C19H23N2
D.將A→C過程中的CH3OH改為C2H5OH,對芬太尼的結構無影響
(3)寫出E→F的化學方程式__________________。
(4)寫出符合下列條件的H的所有同分異構體________。
①含有![]() ②含
②含![]() 結構,且此環上無其它支鏈
結構,且此環上無其它支鏈
③苯環上的一氯代物只有2種
(5)已知: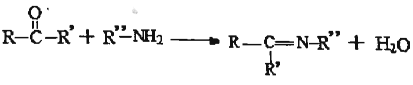 ,設計以環己酮(
,設計以環己酮(![]() )和苯胺(
)和苯胺(![]() )為原料合成有機物
)為原料合成有機物 (用流程圖表示,其他無機試劑任選)。_____
(用流程圖表示,其他無機試劑任選)。_____
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某科研小組公司開發了Li-SO2Cl2軍用電池,其示意圖如圖所示,已知電池反應為:2Li+SO2Cl2=2LiCl+SO2↑。下列敘述中錯誤的是

A. 電池工作時負極材料是Li,發生氧化反應
B. 將電解質溶液改為LiCl的水溶液,電池性能會更好
C. 電池工作時電子流向:鋰電極→導線→負載→碳棒
D. 電池工作過程中,石墨電極反應式為SO2Cl2+2e=2Cl+SO2↑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】海水開發利用的部分過程如圖所示。下列有關說法不正確的是 )
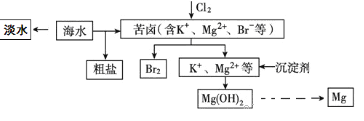
A. 海水淡化的方法主要有蒸餾法、電滲析法、離子交換法等。
B. 空氣吹出法是工業規模海水提溴的常用方法。其工藝的其中一個環節是把氯氣通入酸化的濃縮海水(或苦鹵)中。
C. 在工業上一般選用氫氧化鈉溶液作為圖示中的沉淀劑。
D. 由Mg(OH)2可以制得MgCl2·6H2O,某興趣小組同學設計了如下裝置制取無水MgCl2。其中裝置A的作用是制取干燥的HCl氣體。
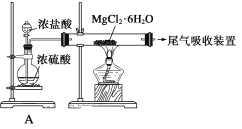
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z、W、Q為原子序數依次增大的前四周期元素,X核外未成對電子數有2個,與其他元素均能形成二元化合物;Y是地殼中含量最多的金屬元素;Z是遺傳物質的組成元素之一;W內層電子數是最外層電子數的9倍;Q基態原子價層電子排布中成對電子數和未成對電子數相同。據此回答下列問題:
(1)Q的基態原子的價層電子排布式為____________________。
(2)電負性最大的是_________________,第一電離能介于Y和Z之間的同周期元素有__________ (填元素符號)。
(3)Y和W的氯化物熔點高的是_________(填化學式),原因是____________________________;與Z的低價氯化物互為等電子體的離子是_____________。
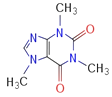
(4)咖啡因對中樞神經有興奮作用,其結構簡式如圖。常溫下,咖啡因在水中的溶解度為2g,加適量水楊酸鈉[C6H4(OH)(COONa)]可使其溶解度增大,其原因可能是_____________________,分子中氮原子的雜化類型有_______________。
(5)已知WX的密度為3.25g/cm3,單元晶胞邊長481pm,試
確定該單元晶胞中含有______個WX,屬于__________立方結構(填寫面心、簡單或體心),晶胞中距離W最近的X有________個。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】200 mL 0.3 mol·L-1的K2SO4溶液和100 mL 0.2 mol·L-1的 Fe2(SO4)3溶液混合后,若忽略液體混合時體積的變化,則溶液中SO42-的物質的量濃度為 ( )
A. 0.3 mol·L-1 B. 0.4 mol·L-1 C. 0.45 mol·L-1 D. 0.6mol/L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】室溫條件下,下列有關電解質溶液的描述正確的是 ( )
A. 向Na2CO3溶液中通入CO2至溶液為中性,則![]()
B. pH相同的氨水和Ba(OH)2溶液中:2c(NH4+)= c( Ba2+)
C. 等濃度的KHSO3溶液與KOH溶液等體積混合:c(OH-)-c(H+)=c(HSO3-)+c(H2SO3)
D. 向Mg(OH)2濁液中加入少量NH4Cl粉末![]() 不變
不變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】磷能形成多種含氧酸。
(1)次磷酸(H3PO2)是一種精細化工產品,向10 mL H3PO2溶液中加入10 mL等物質的量濃度的NaOH溶液后,所得的溶液中只有H2PO2-、OH-兩種陰離子。
① 寫出H3PO2溶液與足量NaOH 溶液反應后形成的正鹽的化學式:_______,該正鹽溶液中各離子濃度由大到小的順序為____________。
② 若25℃時,K (H3PO2) = 1×10-2,則0.01 mol · L-1的H3PO2溶液的pH =________。
(2)亞磷酸(H3PO3)是二元中強酸,25℃時亞磷酸的電離常數為K1= 1×10-2、K2=2.6×10-7。
① 試從電離平衡移動的角度解釋K1、K2數據的差異_______________。
② NaH2PO3溶液顯______性(填“酸”“堿”或“中”)。
(3) 25 ℃時,HF的電離常數為K = 3.6×10-4; H3PO4的電離常數為K1=7.5×10-3,K2=6.2×10-8,K3=4.4×10-13。足量NaF溶液和H3PO4溶液反應的離子方程式為_________。
(4)相同溫度下,等物質的量濃度的上述三種磷的含氧酸中。c(H+)由大到小的順序為_____(用酸的分子式表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】低碳經濟成為人們一種新的生活理念。二氧化碳的捕捉和利用是能源領域的一個重要研究方向。請你結合所學知識回答:
(1)①用CO2催化加氫可制取乙烯:CO2(g)+3H2(g)![]() 1/2C2H4(g)+ 2H2O(g),若 該反應體系的能量隨反應過程變化關系如下圖所示, 則該反應的△H =______(用含a、b的式子表示)。
1/2C2H4(g)+ 2H2O(g),若 該反應體系的能量隨反應過程變化關系如下圖所示, 則該反應的△H =______(用含a、b的式子表示)。

已知:幾種化學鍵的鍵能如下表所示,實驗測得上述反應的△H=-152kJmol﹣1,則表中的x=___________。
化學鍵 | C=O | H-H | C=C | C-H | H-O |
鍵能/kJmol﹣1 | 803 | 436 | x | 414 | 464 |
② 以稀硫酸為電解質溶液,利用太陽能電池將CO2轉化為乙烯的工作原理如下圖所示。則N極上的電極反應式為____________;該電解池中所發生的總反應的化學方程式為__________。
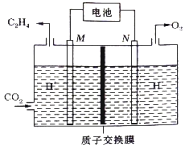
(2)用CO2催化加氫可以制取乙醚的反應如下:2CO2(g)+6H2(g)![]() CH3OCH3(g)+ 3H2O(g) △H=﹣122.5 kJmol﹣1,某壓強下,合成二甲醚的反應在不同溫度、不同投料比時,CO2的平衡轉化率如下圖所示。
CH3OCH3(g)+ 3H2O(g) △H=﹣122.5 kJmol﹣1,某壓強下,合成二甲醚的反應在不同溫度、不同投料比時,CO2的平衡轉化率如下圖所示。

①T1_______T2(填“<”、“=”或“>”),判斷理由是__________________________。
②T1溫度下,將6 mol CO2和12mol H2充入2 L的密閉容器中,經過5 min反應達到平衡,則0~ 5 min內的平均反應速率υ(CH3OCH3)=______。
③一定條件下,上述合成二甲醚的反應達到平衡狀態后,若改變反應的某個條件,下列變化能說明平衡一定向正反應方向移動的是______(填標號)。
A.逆反應速率先增大后減小 B.容器中 c(H2)/c(CO2)的比值減小
C.H2的轉化率增大
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com