
 納米技術制成的金屬燃料、非金屬固體燃料、氫氣等已應用到社會生活和高科技領域.單位質量的A和B的單質燃燒時均放出大量熱,可用作燃料.已知A和B為短周期元素,其原子的第一至第四電離能如下表所示:
納米技術制成的金屬燃料、非金屬固體燃料、氫氣等已應用到社會生活和高科技領域.單位質量的A和B的單質燃燒時均放出大量熱,可用作燃料.已知A和B為短周期元素,其原子的第一至第四電離能如下表所示:| 電離能/(kJ•mol-1) | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |
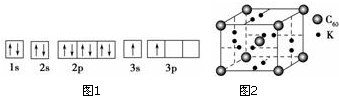
分析 (1)由圖1電子軌道排布圖可知,3s能級未填滿就填充3p能級,3s能級能量比3p能級低,違背了能量最低原理;
(2)BeCl2分子中Be的成2個σ鍵,雜化軌道數為2,采取sp雜化;
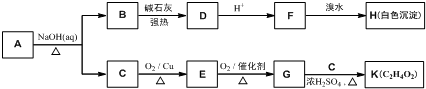
(3)C60是分子晶體,金剛石是原子晶體,決定二者熔沸點的作用力不同;
(4)鉀元素位于第四周期ⅠA族,據此寫出鉀元素價電子排布式;利用均攤法確定K原子和C60分子的個數比;
(5)根據電負性遞變規律判斷電負性大小;根據價電子對互斥理論確定微粒的理論模型;每個硅原子只跟相鄰的3個硅原子形成共價鍵,且每個硅原子最外層都滿足8電子穩定結構,即形成三條共價鍵外,還形成一條π鍵,據此判斷π鍵的數目.
解答 解:(1)①由圖1電子軌道排布圖可知,3s能級未填滿就填充3p能級,所以違背能量最低原理,
故答案為:能量最低原理;
(2)BeCl2分子中Be的成2個σ鍵,雜化軌道數為2,采取sp雜化,
故答案為:sp雜化;
(3)C60是分子晶體,金剛石是原子晶體,決定二者熔沸點的作用力不同,C60為分子晶體,熔化時破壞的是分子間作用力,無需破壞共價鍵
,所以認為C60的熔點高于金剛石是錯誤的,
故答案為:否; C60為分子晶體,熔化時破壞的是分子間作用力,無需破壞共價鍵;
(4)鉀元素位于第四周期ⅠA族,寫出鉀元素價電子排布式為4S1;該晶胞中C60個數=1+8×$\frac{1}{8}$=2,6×2×$\frac{1}{2}$=6,所以K原子和C60分子的個數比為6:2=3:1,
故答案為:4S1;3:1;
(5)電負性同周期從左到右,逐漸增大,同主族從上到下,逐漸減小,則電負性由大到小順序為:N>C>Si;
NCl3中價層電子對個數=σ鍵個數+孤電子對個數=3+$\frac{5-3×1}{2}$=4,所以原子雜化方式是sp3,價層電子對互斥理論模型為為正四面體構型;
Si60分子中,共價鍵數目為60×3×$\frac{1}{2}$=90,每三條共價鍵含有一條π鍵,數目為:90×$\frac{1}{3}$=30,
故答案為:N>C>Si;正四面體;30.
點評 本題考查了位置、結構和性質的關系,題目難度中等,涉及晶胞的計算、電子排布圖、雜化類型判斷、電負性等知識點,試題知識點較多,充分考查了學生靈活應用基礎知識的能力,要求學生能夠運用均攤法計算化學鍵、晶胞的化學式.


 華東師大版一課一練系列答案
華東師大版一課一練系列答案科目:高中化學 來源: 題型:解答題
 ;
; .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 容 器 | 甲 | 乙 |
| 反應物投入量 | 1mol CO2、3mol H2 | a mol CO2、3a mol H2、 b mol CH3OH(g)、b mol H2O(g) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 .
.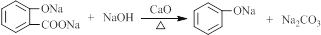 .
.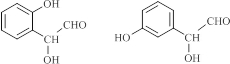 (寫結構簡式).
(寫結構簡式).查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 .固體甲溶于水后,溶液呈堿(酸、堿或中性),寫出甲與水反應的化學方程式NH5+H2O=NH3•H2O+H2↑.
.固體甲溶于水后,溶液呈堿(酸、堿或中性),寫出甲與水反應的化學方程式NH5+H2O=NH3•H2O+H2↑.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 將煤通過物理變化液化后再作為能源,可減少PM2.5引起的危害 | |
| B. | 硫酸亞鐵片和維生素C同時服用,能增強治療缺鐵性貧血的效果 | |
| C. | 普通玻璃屬于無機非金屬材料,有機玻璃屬于新型無機非金屬材料 | |
| D. | 氟氯烴是安全、環保的制冷劑 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 時間/s | 0 | 1 | 2 | 3 | 4 | 5 |
| C(NO)10-4 mol/L | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 |
| C(CO)10-3 mol/L | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 |
| 實驗組 | 溫度/℃ | 起始量/mol | 平衡量/mol | 達到平衡所需時間/min | ||
| H2O | CO | CO | H2 | |||
| i | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
| ii | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
| iii | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NaHCO3溶液顯弱酸性 | |
| B. | 該溶液中K+、Al3+、H+、SO${\;}_{4}^{2-}$可以大量共存 | |
| C. | 加水稀釋該溶液,溶液中$\frac{c(HC{O}_{3}^{-})}{c(C{O}_{3}^{2-})}$增大 | |
| D. | 向該溶液中加入足量的氫氧化鈣溶液的離子方程式為:2HCO${\;}_{3}^{-}$+Ca2++2OH-═CaCO3↓+CO${\;}_{3}^{2-}$+2H2O |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com