
 .固體甲溶于水后,溶液呈堿(酸、堿或中性),寫出甲與水反應的化學方程式NH5+H2O=NH3•H2O+H2↑.
.固體甲溶于水后,溶液呈堿(酸、堿或中性),寫出甲與水反應的化學方程式NH5+H2O=NH3•H2O+H2↑.分析 A、B、C、D四種短周期元素,其原子序數依次增大,其中B與C同周期,A與D同主族,C元素的原子最外層電子數是次外層電子數的三倍,則C為O元素,又知四種元素所形成的常見單質在常溫常壓下有三種是氣體,一種是固體則A為H元素,B為N元素,D為Na元素,據此解答.
(1)由元素B、A形成的化合物BA5,它的所有原子的最外層都符合相應的稀有氣體原子的最外層電結構,可推知A、B均通過電子的轉移形成了離子;
(2)和水反應生成氣體的鈉的含氧化合物有過氧化鈉.
解答 解:(1)N、H在化合物BA5中形成了稀有氣體原子的最外層電結構,一個H原子得到一個電子形成H-離子,故此化合物為 ,屬于離子晶體,
,屬于離子晶體, 溶于水反應生成一水合氨使溶液呈堿性,反應方程式為NH5+H2O=NH3•H2O+H2↑,
溶于水反應生成一水合氨使溶液呈堿性,反應方程式為NH5+H2O=NH3•H2O+H2↑,
故答案為:離子晶體;  ;堿; NH5+H2O=NH3•H2O+H2↑;
;堿; NH5+H2O=NH3•H2O+H2↑;
(2)由O和Na形成的化合物Na2O2溶于水能生成一種氣體,Na2O2與水反應的化學方程式為2Na2O2+2H2O=4NaOH+O2↑,
故答案為:2Na2O2+2H2O=4NaOH+O2↑.
點評 本題考查結構性質位置關系應用,推斷元素是解題關鍵,綜合考查學生分析能力、邏輯推理能力及對知識的遷移運用,需要學生具備扎實的基礎.


科目:高中化學 來源: 題型:解答題
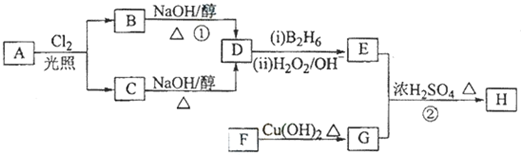
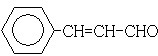 ;
; .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
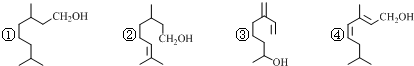
| A. | ①③④互為同分異構體 | |
| B. | ②③④互為同系物 | |
| C. | 上述四種物質中能使酸性KMnO4溶液褪色的只有②③④ | |
| D. | 上述物質分別與足量H2發生加成反應,共可得2種產物 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
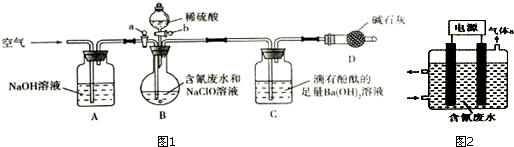
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
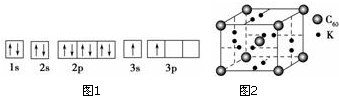 納米技術制成的金屬燃料、非金屬固體燃料、氫氣等已應用到社會生活和高科技領域.單位質量的A和B的單質燃燒時均放出大量熱,可用作燃料.已知A和B為短周期元素,其原子的第一至第四電離能如下表所示:
納米技術制成的金屬燃料、非金屬固體燃料、氫氣等已應用到社會生活和高科技領域.單位質量的A和B的單質燃燒時均放出大量熱,可用作燃料.已知A和B為短周期元素,其原子的第一至第四電離能如下表所示:| 電離能/(kJ•mol-1) | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
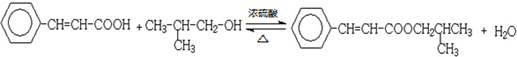
 苯佐卡因是局部麻醉藥,常用于手術后創傷止痛、潰瘍痛等,其結構簡式(如圖),下列關于苯佐卡因的敘述正確的是( )
苯佐卡因是局部麻醉藥,常用于手術后創傷止痛、潰瘍痛等,其結構簡式(如圖),下列關于苯佐卡因的敘述正確的是( )| A. | 分子式為C9H10NO2 | |
| B. | 苯環上有2個取代基,且含有硝基的苯佐卡因的同分異構體有9種 | |
| C. | 1 mol該化合物最多與4 mol氫氣發生加成反應 | |
| D. | 分子中將氨基轉化成硝基的反應為氧化反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 時間/min 溫度/℃ | 0 | 10 | 20 | 40 | 50 |
| T1 | 1.2 | 0.9 | 0.7 | 0.4 | 0.4 |
| T2 | 1.2 | 0.8 | 0.56 | 0.5 | 0.5 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 電離能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| X | 578 | 1817 | 2745 | 11578 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 496 | 4562 | 6912 | 9543 |
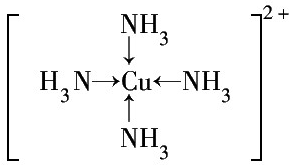 .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com