
| 容器 | 1 | 2 | 3 | 4 |
| 反應物投入量 (始態) | 1mol CO2 3mol H2 | 1mol CH3OH 1mol H2O | 2mol CH3OH 2mol H2O | 0.8mol CO2 2.4mol H2 0.2mol CH3OH 0.2mol H2O |
| CH3OH的平衡濃度/mol•L-1 | c1 | c2 | c3 | c4 |
| 反應的能量變化 | 放出 x kJ | 吸收y kJ | 吸收z kJ | 放出 w kJ |
| 體系壓強/Pa | p1 | p2 | p3 | p4 |
| 反應物轉化率 | a1 | a2 | a3 | a4 |
分析 1容器反應物投入1mol CO2、3mol H2,2容器反應物投入量1mol CH3OH、1mol H2O,4容器反應物的投入量0.8mol CO2、2.4mol H2、0.2mol CH3OH、0.2mol H2O,恒溫恒容,則1容器、2容器與4容器是等效平衡;
2容器反應物投入量1mol CH3OH、1mol H2O,3容器反應物投入量2mol CH3OH、2mol H2O,是2中的二倍,可以看作在恒溫且容積是2容器兩倍條件下,到達平衡后,再壓縮體積為與2容器體積相等所到達的平衡;據此分析平衡移動.
解答 解:1容器反應物投入1mol CO2、3mol H2,2容器反應物投入量1mol CH3OH、1mol H2O,4容器反應物的投入量0.8mol CO2、2.4mol H2、0.2mol CH3OH、0.2mol H2O,恒溫恒容,則1容器、2容器與4容器是等效平衡,則各組分的物質的量、含量、轉化率等完全相等,
2容器反應物投入量1mol CH3OH、1mol H2O,3容器反應物投入量2mol CH3OH、2mol H2O,是2中的二倍,可以看作在恒溫且容積是2容器兩倍條件下,到達平衡后,再壓縮體積為與2容器體積相等所到達的平衡,由于該反應是體積減小的反應,縮小容器體積,增大了壓強,平衡向著正向移動,
A、2、3的反應為CH3OH(g)+H2O(g)?CO2(g)+3H2(g)△H=+49.0kJ•mol-1,3是2投入量的兩倍,若平衡不移動,2c2=c3,2y=z,恒溫、恒容,則3是對2平衡狀態兩倍的基礎上增大壓強,對該反應,增大壓強,平衡逆向移動,則3平衡時CH3OH的平衡濃度大于2的兩倍,2c2<c3;該反應吸熱反應,2/3是從逆反應開始,吸收熱量,3的對于2的平衡向著放熱方向移動,則2y>z,A正確;
B、1、2換算為同種物質表示,投入量相等,屬于等效平衡,則平衡時的狀態一樣:即各物質的濃度相等,p1=p2;根據蓋斯定律可知,1與2的反應的能量變化之和為49.0kJ,故x+y=49.0,B錯誤;
C、3反應物投入量2mol CH3OH、2mol H2O,是2的二倍,若平衡不移動,轉化率α1+α3=1,由于3中相當于增大壓強,平衡向著正向移動,反應物的轉化率減小,所以轉化率α1+α3<1,C正確;
D、設1中反應CO2a mol,則平衡時為CO2(1-a),放出的熱量x=49a,由題x=24.5,則a=$\frac{24.5}{49}$;4中0.8mol CO2、2.4mol H2、0.2mol CH3OH、0.2mol H2O用極限轉移法與1屬于等效平衡,則平衡狀態一樣,CO2也為(1-a),參與反應的 CO2也為0.8-(1-a)=a-0.2,放出的熱量w=(a-0.2)×49,帶入a的值,解得w=14.7,D正確.
故答案為:ACD.
點評 本題考查化學平衡影響因素、等效平衡、化學平衡的計算,題目計算量較大,題目難度較大,關鍵是構建平衡建立的等效途徑,試題側重對學生靈活運用基礎知識解決實際問題的能力的培養.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
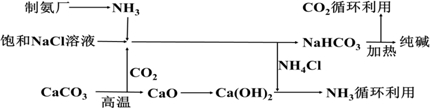
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
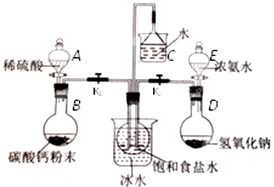
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 溫度/oC | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
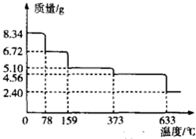 鐵及其化合物在工農業生產、科學研究等方面具有廣泛用途.回答下列問題:
鐵及其化合物在工農業生產、科學研究等方面具有廣泛用途.回答下列問題:| 溫度/℃ | 500 | 700 | 900 |
| K | 1.00 | x | Y |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
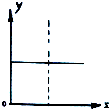
| A. | N2(g)+3H2(g)?2NH3(g),恒容條件下達到平衡后充入He,N2的轉化率與時間的關系 | |
| B. | CH4(g)+H2O(g)?CO(g)+3H2(g);△H>0,平衡后CH4的物質的量與△H的關系 | |
| C. | FeCl3+3KSCN?Fe(SCN)3+3KCl,平衡后加入KCl固體,c(Cl-)與正反應速率關系 | |
| D. | H2(g)+I2(g)?2HI(g),平衡后縮小容器容積,速率與時間的關系 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | M中達到平衡后再通入一定量的氦氣,平衡不移動,容器內氣體的密度不變 | |
| B. | 若x:y=1:2,則平衡時,M中的轉化率:A>B | |
| C. | 若x:y=1:3,當M中放出熱量172.8 kJ時,A的轉化率為90% | |
| D. | N中達到平衡后再通入一定量的氦氣時,v(正)<v(逆) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①③ | B. | ②③ | C. | ②④ | D. | ③④ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com