
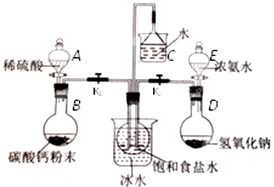
分析 圖中裝置A、B制取二氧化碳,裝置D、E制取氨氣,氨氣極易溶于水,二氧化碳在水中的溶解度較小,先通入氨氣,氨氣與水形成呈堿性的氨水可與二氧化碳與水生成的碳酸發生反應,更有利于二氧化碳氣體的吸收,向飽和食鹽水中通入足量氨氣至飽和,然后通入二氧化碳,析出溶解度較小的碳酸氫鈉,碳酸氫鈉受熱分解制得碳酸鈉.
(1)向飽和食鹽水中通入足量氨氣和過量二氧化碳,析出溶解度較小的碳酸氫鈉,反應的化學方程式為:NaCl+H2O+NH3+CO2═NaHCO3↓+NH4Cl;
(2)實驗需要制備原料氣氨氣與二氧化碳,裝置氣密性要好;
(3)根據儀器的結構特征,可知A為分液漏斗;鹽酸易揮發,用鹽酸制取的二氧化碳中混有氯化氫,氯化氫與碳酸鈉、碳酸氫鈉都能反應;
(4)二氧化碳在水中的溶解度較小,氨氣易溶于水,制取碳酸氫鈉時先要得到含氨的飽和食鹽水;氨水存在平衡:NH3+H2O?NH3•H2O?NH4++OH-,根據平衡移動原理分析生成氨氣;
大約20分鐘左右時,觀察到飽和食鹽水上方有有大量的白霧時,氨氣在氯化鈉溶液中已經飽和;
(5)碳酸氫鈉不穩定,在加熱條件下能分解生成碳酸鈉、水和二氧化碳,濃硫酸具有吸水性,再通過足量的過氧化鈉,發生反應:2Na2O2+2CO2=2Na2CO3+O2,固體增重為與二氧化碳等物質的量的CO的質量,再根據方程式計算純堿質量.
解答 解:圖中裝置A、B制取二氧化碳,裝置D、E制取氨氣,氨氣極易溶于水,二氧化碳在水中的溶解度較小,先通入氨氣,氨氣與水形成呈堿性的氨水可與二氧化碳與水生成的碳酸發生反應,更有利于二氧化碳氣體的吸收,向飽和食鹽水中通入足量氨氣至飽和,然后通入二氧化碳,析出溶解度較小的碳酸氫鈉,碳酸氫鈉受熱分解制得碳酸鈉.(1)向飽和食鹽水中通入足量氨氣和過量二氧化碳,析出溶解度較小的碳酸氫鈉,反應的化學方程式為:NaCl+H2O+NH3+CO2═NaHCO3↓+NH4Cl,所以離子反應方程式為:Na++H2O+NH3+CO2═NaHCO3↓+NH4+,故答案為:Na++H2O+NH3+CO2═NaHCO3↓+NH4+;
(2)模擬工業制備純堿:NaCl+H2O+NH3+CO2═NaHCO3↓+NH4Cl,圖中裝置A、B制取二氧化碳,裝置D、E制取氨氣,裝置氣密性要好,所以儀器按上圖組裝好后,首先應該進行的操作是檢驗裝置氣密性,
故答案為:檢驗裝置的氣密性;
(3)根據儀器特點可知A為分液漏斗,二氧化碳為制備純堿的原料氣體,氯化氫能和碳酸鈉、碳酸氫鈉反應,氯化氫易揮發,用鹽酸和碳酸鈣制取的二氧化碳中混有氯化氫,影響后續反應,所以用難揮發的硫酸分多次和碳酸鈣粉末反應制取二氧化碳,
故答案為:分液漏斗;鹽酸易揮發,CO2中混入HCl;
(4)因氨氣溶解度大,先通入氨氣使溶液呈堿性,增大二氧化碳的吸收量,增大碳酸氫根離子的濃度,所以實驗過程中先通入氨氣,先打開K2,將裝置E中的試劑慢慢加入圓底燒瓶,燒瓶中氫氧化鈉遇水放熱,同時電離出大量OH-離子,使NH3+H2O?NH3•H2O?NH4++OH-平衡逆向移動,產生氨氣,大約20分鐘左右時,觀察到飽和食鹽水上方有大量的白霧時,氨氣在氯化鈉溶液中已經飽和,所以再打開K1,制取二氧化碳通入二氧化碳反應,
故答案為:K2;大量的白霧;K1;
(5)碳酸氫鈉受熱發生的反應為:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,濃硫酸具有吸水性,再通過足量的過氧化鈉,2Na2O2+2CO2=2Na2CO3+O2,固體增重為與二氧化碳等物質的量的CO的質量,n(CO)═0.1mol,根據碳原子守恒:n(CO2)=n(CO)=$\frac{0.28g}{28g/mol}$0.01mol,
由2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,可知n(Na2CO3)=n(CO2)=0.01mol,則制得的純堿質量為:m(Na2CO3)=nM=0.01mol×106g/mol=1.06g,
故答案為:加熱(或灼燒);2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;1.06.
點評 本題是一道有關工業制純堿知識的綜合實驗題目,考查學生分析和解決問題的能力,掌握制堿原理是解題的關鍵,題目難度中等.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 反應物A的轉化率 | B. | 平衡混合氣中物質B的質量分數 | ||
| C. | 平衡混合氣的密度 | D. | 平衡混合氣中C的體積分數 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 溫度升高,Na2CO3溶液中各種離子的濃度均增大 | |
| B. | 沉淀轉化的離子方程式為CO32-(aq)+CaSO4(s)?CaCO3(s)+SO42-(aq) | |
| C. | 該條件下CaCO3的溶解度約為1×10-3g | |
| D. | CaCO3和CaSO4共存的體系中,一定有$\frac{c(S{O}_{4}^{2-})}{c(C{O}_{3}^{2-})}$=9×104 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題

查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| 容器 | 1 | 2 | 3 | 4 |
| 反應物投入量 (始態) | 1mol CO2 3mol H2 | 1mol CH3OH 1mol H2O | 2mol CH3OH 2mol H2O | 0.8mol CO2 2.4mol H2 0.2mol CH3OH 0.2mol H2O |
| CH3OH的平衡濃度/mol•L-1 | c1 | c2 | c3 | c4 |
| 反應的能量變化 | 放出 x kJ | 吸收y kJ | 吸收z kJ | 放出 w kJ |
| 體系壓強/Pa | p1 | p2 | p3 | p4 |
| 反應物轉化率 | a1 | a2 | a3 | a4 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②③⑦⑧ | B. | ①③⑤⑦⑧ | C. | ①③⑤⑧ | D. | ②④⑤⑥⑦ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com