
| A. | 溫度升高,Na2CO3溶液中各種離子的濃度均增大 | |
| B. | 沉淀轉化的離子方程式為CO32-(aq)+CaSO4(s)?CaCO3(s)+SO42-(aq) | |
| C. | 該條件下CaCO3的溶解度約為1×10-3g | |
| D. | CaCO3和CaSO4共存的體系中,一定有$\frac{c(S{O}_{4}^{2-})}{c(C{O}_{3}^{2-})}$=9×104 |
分析 A.升高溫度,促進水解,堿性增強;
B.由Ksp可知,CaCO3更難溶;
C.結合c(CO32-)=c(Ca2+)=$\sqrt{Ksp}$計算;
D.CaCO3和CaSO4共存的體系中,$\frac{c(S{O}_{4}^{2-})}{c(C{O}_{3}^{2-})}$=$\frac{\sqrt{Ksp(CaS{O}_{4})}}{\sqrt{Ksp(CaC{O}_{3})}}$.
解答 解:A.升高溫度,促進水解,堿性增強,Na2CO3溶液中鈉離子濃度不變,氫離子濃度減小,其它離子濃度增大,故A錯誤;
B.由Ksp可知,CaCO3更難溶,沉淀轉化的離子方程式為CO32-(aq)+CaSO4(s)?CaCO3(s)+SO42-(aq),故B正確;
C.由c(CO32-)=c(Ca2+)=$\sqrt{Ksp}$=$\sqrt{1×1{0}^{-10}}$=10-5mol/L,設溶液為1L,則$\frac{S}{100}$=$\frac{1{0}^{-5}mol×100g/mol}{1000g}$,解得S=10-4g,該條件下CaCO3的溶解度約為1×10-4g,故C錯誤;
D.CaCO3和CaSO4共存的體系中,$\frac{c(S{O}_{4}^{2-})}{c(C{O}_{3}^{2-})}$=$\frac{\sqrt{Ksp(CaS{O}_{4})}}{\sqrt{Ksp(CaC{O}_{3})}}$=$\frac{1×1{0}^{-6}}{1×1{0}^{-10}}$=104,故D錯誤;
故選B.
點評 本題考查難溶電解質的溶解平衡,為高頻考點,把握溶解平衡移動、Ksp的計算、沉淀轉化為解答的關鍵,側重分析與應用能力的考查,注意選項C中溶解度的計算為解答的難點,題目難度不大.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:解答題
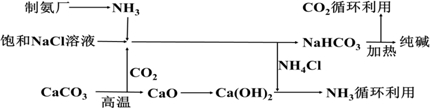
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 在t℃時,AgBr的Ksp為4.9×10-13 | |
| B. | 在t℃時,AgCl(s)+Br-(aq)═AgBr(s)+Cl-(aq)的平衡常數 K≈816 | |
| C. | 圖中a點對應的是AgBr的不飽和溶液 | |
| D. | 在AgBr飽和溶液中加入NaBr固體,可使溶液由c點變到b點 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
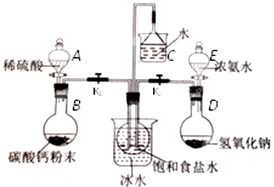
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 溫度/oC | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
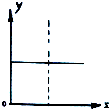
| A. | N2(g)+3H2(g)?2NH3(g),恒容條件下達到平衡后充入He,N2的轉化率與時間的關系 | |
| B. | CH4(g)+H2O(g)?CO(g)+3H2(g);△H>0,平衡后CH4的物質的量與△H的關系 | |
| C. | FeCl3+3KSCN?Fe(SCN)3+3KCl,平衡后加入KCl固體,c(Cl-)與正反應速率關系 | |
| D. | H2(g)+I2(g)?2HI(g),平衡后縮小容器容積,速率與時間的關系 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 質子數與中子數相等的硫原子:${\;}_{16}^{32}$S | |
| B. | Al3+的結構示意圖: | |
| C. | CaO2的電子式: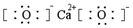 | |
| D. | 2-溴丙烷的結構簡式:C3H7Br |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com