
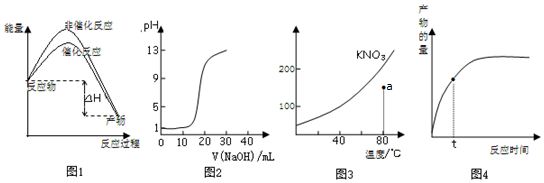
| A. | 圖1表示加入催化劑不影響反應的焓變 | |
| B. | 圖2表示用0.10mol/L CH3COOH溶液滴定20.00 mL0.10mol/LNaOH溶液所得到的滴定曲線 | |
| C. | 圖3表示KNO3的溶解度曲線,圖中點所示的溶液是80℃時KNO3的不飽和溶液 | |
| D. | 圖4表示t時正反應速率大于逆反應速率 |
分析 A、反應物的總能量大于生成物的總能量為放熱反應,使用催化劑可以降低活化分子需要能量;
B、醋酸是弱酸,不能完全電離,據此計算0.10mol/L CH3COOH溶液pH;
C、a點時溶解的硝酸鉀的質量小于80℃時KNO3的溶解度,說明該溶液為不飽和溶液;
D、正反應速率大于逆反應速率,反應正向進行,產物的量逐漸增加.
解答 解:A.反應物的總能量大于生成物的總能量為放熱反應,因此圖象表示的為放熱反應;使用催化劑能夠降低活化分子能量,使用催化劑時需要能量低于不使用催化劑的能量,該圖示與對應的敘述相符,故A正確;
B、醋酸是弱酸,不能完全電離,計算0.10mol/L CH3COOH溶液pH大于1,和圖象不符,故B錯誤;
C.曲線上所有的點代表相應溫度下KNO3溶液的溶解度,均為飽和溶液,a點溶解的KNO3的質量遠小于飽和時的數值,因此a點所示的溶液是80℃時KNO3的不飽和溶液,該說法錯誤,故C正確;
D、正反應速率大于逆反應速率,反應正向進行,產物的量逐漸增加,該圖示與對應的敘述相符,故D正確.
故選B.
點評 本題考查反應熱和焓變、溶解度和飽和溶液、反應速率與化學平衡的關系,題目難度中等,注意明確飽和溶液概念、反應速率與化學平衡的關系,試題側重考查學生運用所學原理從圖象中獲取信息、分析問題、及解決問題的能力.


科目:高中化學 來源: 題型:選擇題
| A. | $\frac{a}{12}$% | B. | $\frac{a}{27}$% | C. | $\frac{1}{9}-\frac{a}{27}$% | D. | 無法計算 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | SiO2溶于水生成的H2SiO3的酸性弱于H2CO3 | |
| B. | SiO2是一種空間立體網狀結構的晶體,熔點高、硬度大 | |
| C. | 在SiO2晶體中,每個硅原子周圍結合2個氧原子 | |
| D. | SiO2是一種酸性氧化物,所以不和任何酸反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在Na2B溶液中一定有:c(OH-)=c(H+)+c(HB-)+2c(H2B) | |
| B. | NaHB溶液可能存在以下關系:c(Na+)>c(HB-)>c(OH-)>c(H+) | |
| C. | NaHB水溶液中一定有:c(Na+)+c(H+)=c(HB-)+c(OH-)+c(B2-) | |
| D. | NaHB溶液一定呈酸性,Na2B溶液一定呈堿性 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
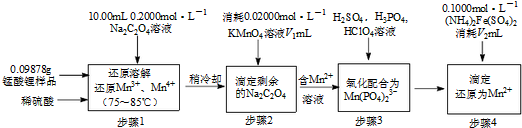
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①③⑤ | B. | ②③④ | C. | ②③⑤ | D. | ①③⑤⑥ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.2mol•L-1的Na2CO3溶液中離子濃度關系:c (Na+)=2c (CO32-)+c (HCO3-)+c (H2CO3) | |
| B. | 0.01mol•L-1的NH4Cl和0.01mol•L-1的NH3•H2O等體積混合后,若測得溶液中c (Cl-)>c (NH4+),則溶液中有關微粒的濃度關系: c (Cl-)>c (NH3•H2O)>c (NH4+)>c (H+)>c (OH-) | |
| C. | 0.1mol的NaHS和0.1mol的NaHSO4混合溶于水,配制成1L溶液,則混合溶液中離子濃度關系為:c (Na+)-0.1mol•L-1=2c (S2-)+c (H2S)+c (HS-) | |
| D. | 0.1mol•L-1的NaHCO3溶液中離子濃度關系:c (OH-)=c (H+)+c (H2CO3)-c (CO32-) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
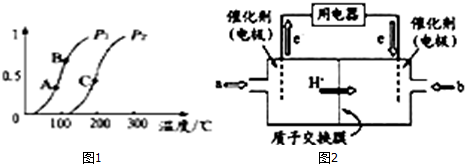
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com