
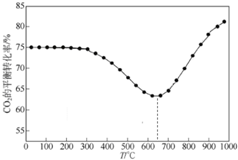
 CO2是自然界中碳循環的主要載體,維持大氣中CO2的平衡對生態環境有重要意義.
CO2是自然界中碳循環的主要載體,維持大氣中CO2的平衡對生態環境有重要意義.分析 (1)二氧化碳參與光合作用,可以實現CO2在自然界碳循環;
(2)①化學平衡常數是指:一定溫度下,可逆反應到達平衡時,生成物的濃度系數次冪之積與反應物的濃度系數次冪之積的比,固體、純液體不需要在化學平衡常數中寫出;
②已知:Ⅰ.CO2(g)+H2(g)?CO(g)+H2O(g)△H=+41.3kJ/mol
Ⅱ.2CO(g)+4H2(g)?C2H4(g)+2H2O(g)△H=-210.5kJ/mol
根據蓋斯定律,Ⅰ×2+Ⅱ可得:2CO2+6H2(g)=C2H4(g)+4H2O(g);
③要提高CO2的轉化率,改變條件應使平衡正向移動,但不能只增大二氧化碳的用量,否則轉化率為降低,結合平衡移動原理分析解答;
④大于650℃時,第一步反應(吸熱)為主,因此升溫使CO2轉化率增大.
解答 解:(1)二氧化碳參與光合作用,可以實現CO2在自然界碳循環,
故答案為:光合作用;
(2)①CO2(g)+H2(g)?CO(g)+H2O(g)的化學平衡常數表達式K=$\frac{c(CO)×c({H}_{2}O)}{c(C{O}_{2})×c({H}_{2})}$,
故答案為:$\frac{c(CO)×c({H}_{2}O)}{c(C{O}_{2})×c({H}_{2})}$;
②已知:Ⅰ.CO2(g)+H2(g)?CO(g)+H2O(g)△H=+41.3kJ/mol
Ⅱ.2CO(g)+4H2(g)?C2H4(g)+2H2O(g)△H=-210.5kJ/mol
根據蓋斯定律,Ⅰ×2+Ⅱ可得:2CO2+6H2(g)=C2H4(g)+4H2O(g)△H=-127.9 kJ/mol,
故答案為:2CO2+6H2(g)=C2H4(g)+4H2O(g)△H=-127.9 kJ/mol;
③a.正反應為氣體體積減小的反應,低壓有利于逆向減小,CO2的轉化率減小,故a錯誤;
b.增大H2濃度,平衡正向移動,CO2的轉化率增大,故b正確;
c.加入適當催化劑,可以加快反應速率,但不影響平衡移動,CO2的轉化率不變,故c錯誤;
d.分離出水,生成物濃度減小,平衡正向移動,CO2的轉化率增大,故d正確,
故選:bd;
④大于650℃時,第一步反應(吸熱)為主,正反應為吸熱反應,升高溫度平衡正向移動,因此升溫使CO2轉化率增大,
故答案為:大于650℃時,第一步反應(吸熱)為主,因此升溫使CO2轉化率增大.
點評 本題考查化學平衡影響因素、平衡常數、蓋斯定律應用等,注意對基礎知識的理解掌握.


 口算題天天練系列答案
口算題天天練系列答案科目:高中化學 來源: 題型:解答題
 太陽能電池是通過光電效應或者光化學效應直接把光能轉化成電能的裝置.其材料除單晶硅,還有銅銦鎵硒等化合物.
太陽能電池是通過光電效應或者光化學效應直接把光能轉化成電能的裝置.其材料除單晶硅,還有銅銦鎵硒等化合物.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 反應后溶液可能呈中性 | |
| B. | 反應停止后一定有固體剩余 | |
| C. | 反應過程中一定有氧化還原反應發生 | |
| D. | 若只有Cu剩余,向溶液中滴入鐵氰化鉀溶液不會產生藍色沉淀 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CaO+H2O═Ca(OH)2 | B. | 2KClO3$\frac{\underline{\;\;△\;\;}}{\;}$2KCl+3O2↑ | ||
| C. | 2NaOH+CO2═Na2CO3+H2O | D. | Fe+2HCl═H2↑+FeCl2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
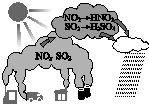
| A. | 汽車尾氣是導致酸雨的原因之一 | B. | 酸雨會使土壤、湖泊酸化 | ||
| C. | 酸雨形成中不涉及氧化還原反應 | D. | 燃煤中加入石灰石可防治酸雨 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 實驗序號 | 實驗操作 | 實驗現象 |
| 實驗1 | 向2mL 0.001mol/L NaHCO3溶液中加入1mL 0.1mol/LCaCl2溶液 | 無明顯變化.用激光筆照射,沒有出現光亮的通路. |
| 實驗2 | 向2mL 0.1mol/L NaHCO3溶液中加入1mL 0.1mol/LCaCl2溶液 | 略顯白色均勻的渾濁,用激光筆照射,出現光亮的通路. |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com