
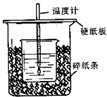
 用50mL 0.50mol/L鹽酸與50mL 0.55mol/LNaOH溶液在如圖所示的裝置中進行中和反應.通過測定反應過程中所放出的熱量可計算中和熱.已知比熱容是4.18J/(g.℃).回答下列問題:
用50mL 0.50mol/L鹽酸與50mL 0.55mol/LNaOH溶液在如圖所示的裝置中進行中和反應.通過測定反應過程中所放出的熱量可計算中和熱.已知比熱容是4.18J/(g.℃).回答下列問題:分析 (1)根據量熱計的構造來判斷該裝置的缺少儀器;
(2)反應放出的熱量和所用酸以及堿的量的多少有關,并根據中和熱的概念和實質來回答;先根據Q=m•c•△T計算反應放出的熱量,然后根據△H=-$\frac{Q}{n}$kJ/mol計算出反應熱;利用中和熱是強酸和強堿反應生成1mol水時放出的熱量來書寫熱化學離子方程式.
解答 解:(1)由量熱計的構造可知該裝置的缺少儀器是環形玻璃攪拌棒,故答案為:環形玻璃攪拌棒;
(2)反應放出的熱量和所用酸以及堿的量的多少有關,用60mL0.50mol/L鹽酸與50mL0.55mol/LNaOH溶液進行反應,與上述實驗相比,生成水的物質的量增多,所放出的熱量偏高,但中和熱是強酸和強堿反應生成1mol水時放出的熱量,與酸堿的用量無關,中和熱數值相等;50mL 0.50mol/L鹽酸與50mL 0.55mol/LNaOH溶液的質量和m=100mL×1g/mL=100g,c=4.18J/(g•℃),溫度差平均值是3.4攝氏度,生成0.025mol的水放出熱量Q=4.18J/(g•℃)×100g×3.4℃=1421.2J=1.4212KJ,即生成0.025mol的水放出熱量1.4212kJ,反應熱△H=-$\frac{Q}{n}$=-$\frac{1.4212kJ}{0.025mol}$=-56.85kJ/mol,即該實驗測得的中和熱△H=-56.8kJ/mol;熱化學離子方程式:H+(aq)+OH-(aq)═H2O(l)△H=-56.85 kJ/mol;
故答案為:相等;H+(aq)+OH-(aq)═H2O(l)△H=-56.85 kJ/mol.
點評 本題考查中和熱的測定與計算,題目難度中等,注意理解中和熱的概念是解題的關鍵.


科目:高中化學 來源: 題型:選擇題
| A. | 反應①、②均為氧化還原反應 | |
| B. | 反應①中氧化產物與還原產物的物質的量之比為1:1 | |
| C. | 上述尾氣N0x的吸收過程中.共轉移電子的物質的量為1mol | |
| D. | 上述尾氣中NO2與N0的體積比為6:1. |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 離子 | Cu2+ | H+ | Cl- | SO42- |
| c/mol•L-1 | 0.5 | 2 | 2 | 0.5 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 一定條件下,Cl2可在甲苯的苯環或側鏈上發生取代反應 | |
| B. | 苯能使溴水褪色,是因為苯與溴發生了化學反應 | |
| C. | 乙烷和丙烯的物質的量共1mol,完全燃燒生成3 mol H2O | |
| D. | 光照下2,2二甲基丙烷與Br2反應,其一溴取代物只有一種 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
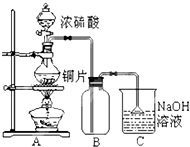 某研究性學習小組的同學為驗證濃硫酸與銅能反應而稀硫酸不能,設計了如圖所示裝置進行探究:將6.4g 銅片和含0.2moL溶質的18.4mol/L濃硫酸放在圓底燒瓶中共熱,直到無氣體生成為止.(假定在此過程溶液體積不變)
某研究性學習小組的同學為驗證濃硫酸與銅能反應而稀硫酸不能,設計了如圖所示裝置進行探究:將6.4g 銅片和含0.2moL溶質的18.4mol/L濃硫酸放在圓底燒瓶中共熱,直到無氣體生成為止.(假定在此過程溶液體積不變)| 序號 | 不合理的原因 | 誤差 (偏低或偏高) | 改變措施 |
| 方案① | 高錳酸鉀溶液中含有硫酸,與氯化鋇反應,使生成的沉淀增多 | 偏低 | 將硫酸酸化的高錳酸鉀溶液換成溴水或碘水或硝酸溶液 |
| 方案② | 不填 | 不填 | 不填 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
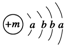 ,X的陽離子與Y的陰離子的電子層結構相同.元素Z、W均為短周期元素,它們原子的最外層電子數均是其電子層數的2倍,Z與Y相鄰且Z、W能形成一種WZ2型分子.
,X的陽離子與Y的陰離子的電子層結構相同.元素Z、W均為短周期元素,它們原子的最外層電子數均是其電子層數的2倍,Z與Y相鄰且Z、W能形成一種WZ2型分子. .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
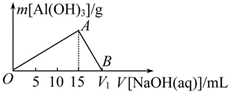 向20mL某濃度的AlCl3溶液中滴加2mol•L-1的NaOH溶液時,所得沉淀的質量與加入NaOH溶液的體積之間的關系如圖所示:
向20mL某濃度的AlCl3溶液中滴加2mol•L-1的NaOH溶液時,所得沉淀的質量與加入NaOH溶液的體積之間的關系如圖所示:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com