
| 離子 | Cu2+ | H+ | Cl- | SO42- |
| c/mol•L-1 | 0.5 | 2 | 2 | 0.5 |
分析 ①甲醇燃料電池甲醇在負極失電子,堿溶液中生成碳酸鹽,依據溶液中氫氧根離子配平電荷守恒;
②根據原電池原理,正極O2得到電子生成負極O2-;依據電解原理和溶液中離子放電順序,結合電子守恒和電極反應計算得到.
解答 解:①燃料電池,電池的一個電極通 入空氣,另一個電極通入甲醇氣體,電解質是氫氧化鈉溶液,根據原電池原理,正極電極反應是O2得到電子生成氫氧根離子-:O2+2H2O+4e-=4OH-,負極電極反應:CH3OH-6e-+8OH-=CO32-+6H2O;
故答案為:CH3OH-6e-+8OH-=CO32-+6H2O;
②燃料電池,電池的一個電極通入空氣,另一個電極通入甲醇氣體,電解質是氫氧化鈉溶液,根據原電池原理,正極電極反應是O2得到電子生成氫氧根離子:O2+2H2O+4e-=4OH-,負極電極反應:CH3OH-6e-+8OH-=CO32-+6H2O;電解一段時間后,當兩極收集到相同體積(相詞條件)的氣體時(忽略溶液體積的變化及電極產物可能存在的溶解現象),根據電極反應:
陽極電極反應為:2Cl--2e-=Cl2↑,4OH--4e-=2H2O+O2↑,
0.4mol 0.4mol 0.2mol 4x x
陰極電極反應為:Cu2++2e-=Cu,
0.1mol 0.2mol 0.1mol
2H++2e-=H2↑; 2H++2e-=H2↑;
0.4mol 0.4mol 0.2mol 2x x
依據電子守恒0.4+4x=0.2+0.4+2x,x=0.1mol,陽極上收集到氧氣的物質的量0.1mol,所以陽極上發生的反應是2Cl--2e-=Cl2↑;4OH--4e-=2H2O+O2↑.
故答案為:2Cl--2e-=Cl2↑;4OH--4e-=2H2O+O2↑.
點評 本題考查原電池和電解池的工作原理以及電極反應的書寫和計算知識,掌握基礎是關鍵,題目難度中等.


 中考利劍中考試卷匯編系列答案
中考利劍中考試卷匯編系列答案 教育世家狀元卷系列答案
教育世家狀元卷系列答案 黃岡課堂作業本系列答案
黃岡課堂作業本系列答案科目:高中化學 來源: 題型:選擇題
| A. | CH3CH2CH3與CH4互為同系物 | |
| B. | 乙醇和乙酸都能與金屬鈉反應 | |
| C. | 正丁烷(CH3CH2CH2CH3)與異丁烷(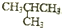 )互為同分異構體 )互為同分異構體 | |
| D. | 甲烷與苯在空氣中燃燒的現象相同 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 物質 | CH3OH | CH3OCH3 | H2O |
| 濃度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用過量氨水吸收工業尾氣中的SO2:NH3•H2O+SO2═NH4++SO32-+H2O | |
| B. | MnO2與濃鹽酸反應制Cl2:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl-+Cl2↑+2H2O | |
| C. | 向FeBr2溶液中通入足量氯氣:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| D. | 醋酸除去水垢:2H++CaCO3═Ca2++CO2↑+H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
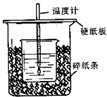 用50mL 0.50mol/L鹽酸與50mL 0.55mol/LNaOH溶液在如圖所示的裝置中進行中和反應.通過測定反應過程中所放出的熱量可計算中和熱.已知比熱容是4.18J/(g.℃).回答下列問題:
用50mL 0.50mol/L鹽酸與50mL 0.55mol/LNaOH溶液在如圖所示的裝置中進行中和反應.通過測定反應過程中所放出的熱量可計算中和熱.已知比熱容是4.18J/(g.℃).回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NaCl和AgNO3 | B. | Na2CO3和稀鹽酸 | C. | Al2(SO4)3和NaOH | D. | 鹽酸和Na[Al(OH)4] |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
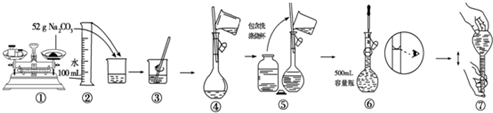
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com