
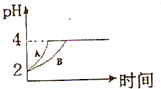
 現有室溫下濃度均為1×10-3mol/L的幾種溶液:①鹽酸、②醋酸、③氨水、④NaOH溶液,回答下列問題:
現有室溫下濃度均為1×10-3mol/L的幾種溶液:①鹽酸、②醋酸、③氨水、④NaOH溶液,回答下列問題:分析 (1)將等體積的①、③混合是鹽酸和氨水恰好完全反應生成氯化銨溶液,銨根離子水解溶液顯酸性;
(2)將②醋酸、④NaOH溶液混合后,若溶液呈中性,酸應略微過量,溶液中為醋酸和醋酸鈉的混合溶液;
(3)從醋酸是弱電解質的角度分析,醋酸與Zn反應同時,電離出H+,pH變化較緩慢.
解答 解:(1)將等體積的①、③混合是鹽酸和氨水恰好完全反應生成氯化銨溶液,銨根離子水解溶液顯酸性,離子方程式為:NH4++H2O?NH3•H2O+H+,
故答案為:<;NH4++H2O?NH3•H2O+H+;
(2)將②醋酸、④NaOH溶液混合后,若溶液呈中性,酸應略微過量,則消耗兩溶液的體積②>④,溶液中為醋酸和醋酸鈉的混合溶液溶液中各離子的濃度由大到小的順序為:c(Na+)=c(CH3COO-)>c(H+)=c(OH-),
故答案為:>;c(Na+)=c(CH3COO-)>c(H+)=c(OH-);
(3)由于醋酸是弱電解質,與Zn反應同時,電離出H+,所以pH變化較緩慢,所以B曲線是醋酸溶液的pH變化曲線.由圖知鹽酸和醋酸的pH變化都是由2到4,鹽酸中氫離子濃度逐漸減小,但醋酸中存在電離平衡,氫離子和鋅反應時促進醋酸電離,補充反應的氫離子,所以醋酸是邊反應邊電離H+,故消耗的Zn多,所以m1<m2.
故答案為:B;<.
點評 本題考查了弱電解質電離平衡、酸堿反應溶液酸堿性的判斷、電解質溶液中電荷守恒和離子濃度比較,題目難度中等.


 智能訓練練測考系列答案
智能訓練練測考系列答案科目:高中化學 來源: 題型:選擇題
| A. | ②④⑤ | B. | ①④⑤ | C. | ①⑤ | D. | ①③ |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 分解高錳酸鉀制氧氣后,殘留在試管內壁上的黑色物質可用稀鹽酸洗滌 | |
| B. | 將CuCl2溶液在蒸發皿中加熱蒸干,得到無水CuCl2固體 | |
| C. | 失去標簽的硝酸銀溶液、稀鹽酸、氫氧化鈉溶液、氯化鋁溶液,可以用碳酸銨溶液鑒別 | |
| D. | 檢驗從火星上帶回來的紅色物體是否是Fe2O3的操作步驟為:樣品→粉碎→加水溶解→過濾→向濾液中滴加KSCN溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
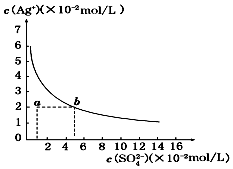
| A. | 含有大量SO42-的溶液中肯定不存在Ag+ | |
| B. | 0.02 mol/L的AgNO3溶液與0.2 mol/L的Na2SO4溶液等體積混合不會生成沉淀 | |
| C. | Ag2SO4的溶度積常數(Ksp)為1×10-3 | |
| D. | a點表示Ag2SO4的不飽和溶液,蒸發可以使溶液由a點變到b點 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | v (C)=3 mol/(L•min) | B. | v (D)=0.5 mol/(L•s) | ||
| C. | v (B)=0.6 mol/(L•s) | D. | v (A)=12 mol/(L•min) |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com