
| A. | 沸點:PH3>NH3>H2O | |
| B. | CO2分子中的化學鍵為非極性鍵 | |
| C. | NH3分子中N原子的雜化軌道類型是sp2 | |
| D. | NH4+為正四面體結構,可推測出PH4+也為正四面體結構 |
分析 A、含有氫鍵的氫化物的沸點較高,分子間形成氫鍵數目越多,沸點越高,水的沸點100℃,而氨氣常溫下為氣體;
B、根據不同種元素形成的共價鍵為極性鍵;
C、NH3中價層電子對個數=σ鍵個數+孤電子對個數=3+$\frac{1}{2}$×(5-3×1)=4,中心原子是以sp3雜化;
D、根據價層電子對互斥模型判斷.
解答 解:A、含有氫鍵的氫化物的沸點較高,分子間形成氫鍵數目越多,沸點越高,所以沸點:PH3<NH3<H2O,故A錯誤;
B、二氧化碳結構為O=C=O,為極性鍵,故B錯誤;
C、NH3中價層電子對個數=σ鍵個數+孤電子對個數=3+$\frac{1}{2}$×(5-3×1)=4,中心原子是以sp3雜化,故C錯誤;
D、NH4+和PH4+中,中心原子都形成4個δ鍵,沒有孤電子對,為正四面體結構,故D正確;
故選D.
點評 本題考查較為綜合,涉及元素周期律的遞變規律、離子的空間結構、晶體的類型以及化合物的類型的判斷,側重于基礎知識的考查,題目難度不大,注意把握元素周期律的遞變規律以及元素的性質與對應單質、化合物性質的關系.


科目:高中化學 來源: 題型:解答題

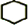 ,名稱是環己烷.
,名稱是環己烷. +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$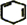 +2NaBr+2H2O.
+2NaBr+2H2O.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 酸與堿發生中和反應所放出的熱量稱為中和熱 | |
| B. | 若某反應的反應物的總能量大于生成物的總能量,則該反應為吸熱反應 | |
| C. | H2→H+H的變化需要吸收能量 | |
| D. | 凡經加熱而發生的化學反應都是吸熱反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 通過測同溫同濃度下的Na2CO3和Na2SO3水溶液的pH可以確定碳和硫兩元素非金屬性強弱 | |
| B. | 苯的密度比水小,但由苯反應制得的溴苯、硝基苯、環己烷的密度都比水大 | |
| C. | Fe2+、SO2都能使酸性高錳酸鉀溶液褪色,前者表現出還原性,后者表現出漂白性 | |
| D. | 總質量一定時,甲醛和乙酸無論按什么比例混合,完全燃燒消耗氧氣量或生成CO2量不變 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 它可由PH3和HI化合而成 | |
| B. | 加熱時PH4I可以分解,而且有顏色變化 | |
| C. | 它可以跟NaOH反應 | |
| D. | 它是一種共價化合物 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 電子排布式1s22s22p63s23p64s3違反了泡利原理 | |
| B. | 基態原子電子排布式1s22s22p63s23p63d5違反了能量最低原理 | |
| C. | 根據構造原理,原子核外電子填充順序為1s2s2p3s3p4s3d4p5s5p4d6s4f5d6p | |
| D. | 某主族元素氣態基態原子的逐級電離能分別為738、1451、7733、10540、13630、17995、21703…,當它與氯氣反應時生成的陽離子是X2+ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氯氣是氧化劑,水是還原劑 | B. | 水被還原,氯氣被氧化 | ||
| C. | 氯氣既是氧化劑,又是還原劑 | D. | 該反應不是氧化還原反應 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com