
 Si(s)+3HCl(g)。
Si(s)+3HCl(g)。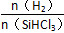 時,反應物X的平衡轉化率關系如圖所示。
時,反應物X的平衡轉化率關系如圖所示。
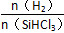 增大,X的平衡轉化率增大,則X是SiHCl3。②當
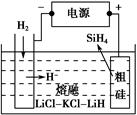
增大,X的平衡轉化率增大,則X是SiHCl3。②當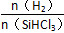 一定時,升高溫度,SiHCl3的平衡轉化率增大,則表明化學平衡常數K(1 150 ℃)>K(950 ℃)。(3)①電解時陽極發生氧化反應,粗硅失去電子,結合H-生成SiH4氣體,則電極反應式為Si+4H--4e-=SiH4↑。②Si、N元素組成的化合物中Si的質量分數為60%,則
一定時,升高溫度,SiHCl3的平衡轉化率增大,則表明化學平衡常數K(1 150 ℃)>K(950 ℃)。(3)①電解時陽極發生氧化反應,粗硅失去電子,結合H-生成SiH4氣體,則電極反應式為Si+4H--4e-=SiH4↑。②Si、N元素組成的化合物中Si的質量分數為60%,則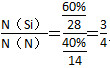 ,即化學式為Si3N4。
,即化學式為Si3N4。

科目:高中化學 來源:不詳 題型:單選題
| A.鋰離子電池充電時電池反應為C6Li+Li1-xMO2==LiMO2+C6Li1-x |
| B.電池反應中,鋰、鋅、銀、鉛各失去1mol電子,金屬鋰所消耗的質量最小 |
| C.鋰離子電池放電時電池內部Li+向負極移動 |
| D.鋰離子電池充電時陰極反應為C6Li1-x+xLi++x e-==C6Li |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.鋅錳干電池中Zn為正極,碳棒為負極 |
| B.鋅錳干電池工作時,電子由碳極經外電路流向Zn極 |
| C.鋅錳干電池長時間連續使用時內裝糊狀物會流出腐蝕電器 |
| D.鋅錳干電池能將化學能轉化為電能和將電能轉化為化學能 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題


 2NH3(g)ΔH1<0,實驗Ⅰ、Ⅱ、Ⅲ中c(N2)隨時間(t)的變化如圖所示(T表示溫度)。
2NH3(g)ΔH1<0,實驗Ⅰ、Ⅱ、Ⅲ中c(N2)隨時間(t)的變化如圖所示(T表示溫度)。 NH3?H2O(aq)+H+(aq)的化學平衡常數為5.55×10-10 mol·L-1,則NH3?H2O的電離平衡常數K= (保留三位有效數字)。
NH3?H2O(aq)+H+(aq)的化學平衡常數為5.55×10-10 mol·L-1,則NH3?H2O的電離平衡常數K= (保留三位有效數字)。查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
 CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3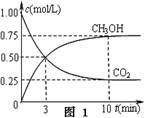
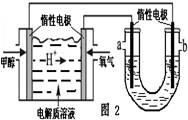
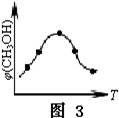
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.向醋酸鈉溶液中加水稀釋時,溶液中所有離子濃度都減小 |
| B.電解精煉銅時,陽極泥中含有Zn、Fe、Ag、Au等金屬 |
| C.8NH3(g)+6NO2(g)=7N2(g)+12H2O(g) △H<0,則該反應一定能自發進行 |
D.對N2(g)+3H2(g) 2NH3(g),其他條件不變時充入N2,正反應速率增大,逆反應速率減小 2NH3(g),其他條件不變時充入N2,正反應速率增大,逆反應速率減小 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.任何化學反應不一定都有反應熱 |
| B.使用催化劑可以改變反應的平衡常數 |
| C.升高溫度使反應加快,是因為降低了反應的活化能 |
| D.對于同一個化學反應,無論是一步完成還是分幾步完成,其反應的焓變相同 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.反應CaCO3(s)=CaO(s)+CO2(g)在常溫下不能發生,則該反應的△H>0 |
B.0.1 mol·L-1CH3COOH溶液加水稀釋后,溶液中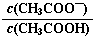 的值減小 的值減小 |
| C.鉛蓄電池在放電過程中,負極質量增加,正極質量減少 |
| D.鍋爐中沉積的CaSO4可用飽和Na2CO3溶液浸泡,再將不溶物用稀鹽酸溶解除去 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
 H2+I2
H2+I2
 2HI(g)的平衡常數K=__________________
2HI(g)的平衡常數K=__________________查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com