

| A. | a極是正極 | B. | 電池總反應式為:2H2+O2=2H2O | ||
| C. | 電子由b通過燈泡流向a | D. | 氫氧燃料電池是環保電池 |
分析 氫氧燃料電池中,通入氫氣的一極為電源的負極,發生氧化反應,電極反應式為H2-2e-=2H+,通入氧氣的一極為原電池的正極,電極反應式為O2+4H++4e-=2H2O,原電池工作時,電子由負極經外電路流向正極,以此解答該題.
解答 解:A.氫氧燃料電池中,H2在負極a上被氧化,故A錯誤;
B.通入氧氣的一極為原電池的正極,由于電解質溶液為酸性,正極的電極反應是O2+4H++4e-=2H2O,負極反應為H2-2e-=2H+,則總方程式為2H2+O2=2H2O,故B正確;
C.原電池工作時,電子由負極經外電路流向正極,即由a通過燈泡流向b,故C錯誤;
D.氫氧燃料電池的總反應為:2H2+O2=2H2O,屬于環保電池,故D正確.
故選AC.
點評 本題考查原電池的工作原理,為高頻考點,側重于學生的分析能力的考查,題目難度不大,注意把握電極方程式的書寫,特別是電解質溶液的酸堿性.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:選擇題
| A. | 反應產物的總焓與反應物的總焓之差,稱為反應焓變 | |
| B. | 反應產物的總焓小于反應物的總焓,該反應為吸熱反應 | |
| C. | 同一反應在不同溫度下進行,其焓變是不同的 | |
| D. | 已知2NO2(g)═N2O4(g)△H1,N2O4(g)═2NO2(g)△H2,則△H1=-△H2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫常壓下,20 g D2O和足量的金屬鈉反應產生氣體的分子數為0.5NA | |
| B. | 1 mol Na2O2與足量的水反應,轉移的電子數為2NA | |
| C. | NA 個SO3分子在標準狀況下的體積為22.4 L | |
| D. | 25℃時,pH=13的1.0 L Ba(OH)2溶液中含有的OH-數目為0.2NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氣態氫化物的穩定性:D>C | |
| B. | 原子序數:b>a>c>d | |
| C. | 最高價氧化物對應水化物的堿性:B>A | |
| D. | 原子半徑:B>A>D>C |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 44.8 L氟化氫氣體分解成22.4 L的氫氣和22.4 L的氟氣吸收546.6 kJ熱量 | |
| B. | 1 mol氫氣與1 mol氟氣反應生成2 mol液態氟化氫放出的熱量大于546.6 kJ | |
| C. | 相同條件下,1 mol氫氣與1 mol氟氣的能量總和高于2 mol氟化氫氣體的能量 | |
| D. | 2 mol H-F鍵的鍵能比1 mol H-H鍵和1 mol F-F 鍵的鍵能之和大546.6 kJ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 催化劑能使不起反應的物質發生反應 | |
| B. | 在化學反應前后催化劑性質和質量都不改變 | |
| C. | 催化劑能改變化學反應速率 | |
| D. | 在化學反應過程中,催化劑能提高轉化率 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向10ml 0.1mol•L-1NH4HSO4溶液中滴加10ml 0.1mol•L-1NaOH溶液:2c(SO42-)═c(NH4+)+c(NH3•H2O) | |
| B. | 等體積等濃度NaHCO3溶液和Na2CO3溶液混合:$\frac{C(HC{O}_{3}^{-})}{C({H}_{2}C{O}_{3})}$<$\frac{C(C{O}_{3}^{2-})}{C(HC{O}_{3}^{-})}$ | |
| C. | 物質的量濃度均為0.1mol•L-1Na2S溶液、NaHS溶液等體積混合所得溶液中:2c(OH--)-2c(H+)═3 c(H2S)+c(HS--)-c(S2--) | |
| D. | 將足量的AgCl分別放入:①5 ml水 ②10 ml 0.2mol•L-1MgCl2溶液③20ml0.3mol•L-1鹽酸中溶解至飽和,c(Ag+):①>②>③ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 新制的氯水中:Ba2+、Fe2+、CO32- | |
| B. | 0.1 mol•L-1HNO3溶液中:Mg2+、SO42-、Cl- | |
| C. | 0.1 mol•L-1NH4Cl溶液中:K+、OH-、SO42- | |
| D. | 使石蕊變紅色的溶液中:Na+、Cu2+、HCO3- |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
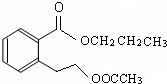 或
或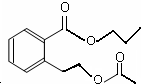 .
.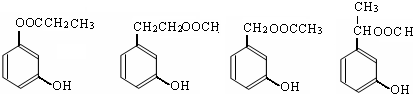 (任意兩個).
(任意兩個).
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com