
【題目】將標準狀況下2.24 L CO2緩慢通入1 L 0.15 mol·L-1的NaOH溶液中,氣體被充分吸收,下列關系不正確的是( )
A. 混合溶液溶質為NaHCO3和Na2CO3
B. c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)
C. c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
D. 加熱蒸干所得混合溶液,最終得到Na2CO3固體
【答案】C
【解析】
A、先判斷CO2與NaOH反應后的產物,利用元素守恒進行計算;B、利用電荷守恒進行判斷;C、利用CO32-的水解能力強于HCO3-進行分析;D、注意NaHCO3不穩定,受熱易分解。
A、根據C元素守恒,有n(NaHCO3)+n(Na2CO3)=2.24/22.4=0.1mol,根據Na元素守恒,有n(NaHCO3)+2n(Na2CO3)=1×0.15mol,解得n(Na2CO3)=0.05mol,n(NaHCO3)=0.05mol,故A說法正確;B、根據電荷守恒,因此有c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),故B說法正確;C、CO32-的水解能力強于HCO3-,即CO32-+H2O![]() HCO3-+OH-,因此離子濃度大小順序是 c(Na+)>c(HCO3-)> c(CO32-) >c(OH-)>c(H+),故C說法錯誤;D、加熱蒸干后得到Na2CO3和NaHCO3,因為NaHCO3不穩定,受熱易分解,2NaHCO3
HCO3-+OH-,因此離子濃度大小順序是 c(Na+)>c(HCO3-)> c(CO32-) >c(OH-)>c(H+),故C說法錯誤;D、加熱蒸干后得到Na2CO3和NaHCO3,因為NaHCO3不穩定,受熱易分解,2NaHCO3![]() Na2CO3+CO2↑+H2O,因此最終得到物質為Na2CO3,故D說法正確。
Na2CO3+CO2↑+H2O,因此最終得到物質為Na2CO3,故D說法正確。


 黎明文化寒假作業系列答案
黎明文化寒假作業系列答案科目:高中化學 來源: 題型:
【題目】工業上利用氨氧化獲得的高濃度NOx氣體(含NO、NO2)制備NaNO2、NaNO3,工藝流程如下:
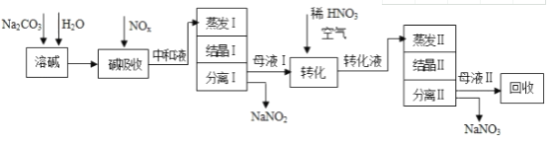
已知:Na2CO3+NO+NO2═2NaNO2+CO2
(1)中和液所含溶質除NaNO2及少量Na2CO3外,還有_________________(填化學式)。
(2)中和液進行蒸發Ⅰ操作時,應控制水的蒸發量,避免濃度過大,目的是_____________;蒸發Ⅰ產生的蒸汽中含有少量的NaNO2等有毒物質,不能直接排放,將其冷凝后用于流程中的_____________________(填操作名稱)最合理。
(3)母液Ⅰ進行轉化時加入稀HNO3的目的是______________________________;母液Ⅱ需回收利用,下列處理方法合理的是_______。
a.轉入中和液 b.轉入結晶Ⅰ操作 c.轉入轉化液 d.轉入結晶Ⅱ操作
(4)若將NaNO2、NaNO3兩種產品的物質的量之比設為2:1,則生產1.38噸NaNO2時,Na2CO3的理論用量為______________噸(假定Na2CO3恰好完全反應)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)H2A在水中存在以下平衡:H2A![]() H++HA-,HA-
H++HA-,HA-![]() H++A2-。NaHA溶液顯酸性,則溶液中離子濃度的大小順序為__________________________。
H++A2-。NaHA溶液顯酸性,則溶液中離子濃度的大小順序為__________________________。
(2)已知常溫下H2A的鈣鹽(CaA)飽和溶液中存在以下平衡:CaA(s)![]() Ca2+(aq)+A2-(aq)滴加少量Na2A固體,c(Ca2+)___(填“增大”“減小”或“不變”),原因是______。
Ca2+(aq)+A2-(aq)滴加少量Na2A固體,c(Ca2+)___(填“增大”“減小”或“不變”),原因是______。
(3)含有![]() 的廢水毒性較大,某工廠廢水中含4.00×10-3 mol·L-1的Cr2O
的廢水毒性較大,某工廠廢水中含4.00×10-3 mol·L-1的Cr2O![]() 。為使廢水能達標排放,作如下處理:
。為使廢水能達標排放,作如下處理:![]()
![]() Cr2+、Fe3+
Cr2+、Fe3+![]() Cr(OH)3、Fe(OH)3
Cr(OH)3、Fe(OH)3
①該廢水中加入FeSO4·7H2O和稀硫酸,發生反應的離子方程式為:_______。
②若處理后的廢水中殘留的c(Fe3+)=1×10-13 mol·L-1,則殘留的Cr3+的濃度為__________________。{已知:Ksp[Fe(OH)3]≈1.0×10-38 ,Ksp[Cr(OH)3]≈1.0×10-31}
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于基本營養物質說法不正確的是
A.家庭做菜用的菜籽油、花生油和豬油都屬于酯類
B.疫苗需冷凍保藏,是防止蛋白質變性
C.蔗糖水解得到葡糖糖和果糖,麥芽糖水解只得到葡萄糖,蔗糖和麥芽糖是同分異構體
D.糖類和蛋白質都是人體必需的營養物質,都屬于高分子化合物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】《漢書》中“高奴縣有洧水可燃”,沈括在《夢溪筆談》對“洧水”的使用有“予知其煙可用,試掃其煙為墨,黑光如漆,松墨不及也,此物必大行于世”的描述,對上文進行的某些分析中正確的是
A. “洧水”的主要成分是油脂
B. “洧水”的主要成分是煤油
C. 煙的主要成分是炭黑
D. 煙的主要成分是石墨
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】周期表前四周期的元素A、B、C、D、E、F,原子序數依次增大,A是周期表中原子半徑最小的元素,B的基態原子中只有1個未成對電子,C基態原子中有7種不同運動狀態的電子,D的最外層電子數是其所處周期數的3倍,E與D同主族,F的一價陽離子最外層有18個電子。回答下列問題:
(1)F在周期表中的位置是_____________,它的基態原子的電子排布式為_____________
(2)A元素與其他元素形成的含氧酸中,酸根呈三角錐結構的酸是_________,該酸的中心原子的雜化方式為_________
(3)CA3極易溶于水,試從下圖中判斷CA3溶于水后形成CA3·H2O的合理結構為_____(填字母代號),推理依據是___________

(4)元素B可形成H3BO3,已知H3BO3的電離方程式為H3BO3+2 H2O![]() [B(OH)4]一+H3O+
[B(OH)4]一+H3O+
①基態B、D原子的第一電離能由小到大的順序為__________(用元素符號表示)
②[B(OH)4]一中B原子的雜化類型為_______________
③寫出一種與H3O+互為等電子體的分子的化學式:___________
④H3BO3晶體在熱水中的溶解度大于冷水中的溶解度的原因為__________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以苯為基礎原料,可以合成多種有機物。

回答下列問題:
(1)由苯合成有機物A用到的無機試劑為______________
(2)B分子中的官能團的名稱為__________,生成PF樹脂的反應類型為_____________
(3)由B生成C的化學方程式為_____________
(4)試劑D可以是___________________(填代號)
a.溴水 b.高錳酸鉀溶液 c.Ag(NH3)2OH溶液 d.新制Cu(OH)2懸濁液
(5)寫出同時滿足下列條件的肉桂酸乙酯的一種同分異構體________________
①苯環上僅有2個取代基且處于對位
②能發生水解反應和銀鏡反應,其中一種水解產物遇FeCl3溶液顯紫色
③為順式異構
(6)以乙醇為原料合成CH3-CH=CH-COOCH2CH3,其他試劑任選,寫出合成路線_____________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮及其化合物是科學家們一直在探究的問題,它們在工農業生產和生命活動中起著重要的作用。回答下列問題。
Ⅰ.已知H—H鍵的鍵能為436kJ·mol-1,N—H鍵的健能為391kJ·mol-1,N![]() N鍵的鍵能是945.6 kJ·mol-1,則反應NH3(g)
N鍵的鍵能是945.6 kJ·mol-1,則反應NH3(g)![]()
![]() N2(g)+
N2(g)+![]() H2(g)的ΔH=______,若在某溫度下其平衡常數為K,則N2(g)+3H2(g)
H2(g)的ΔH=______,若在某溫度下其平衡常數為K,則N2(g)+3H2(g) ![]() 2NH3(g)的平衡常數K1=___________(用K表示)
2NH3(g)的平衡常數K1=___________(用K表示)
Ⅱ.氯氨是氯氣遇到氨氣反應生成的一類化合物,是常用的飲用水二級消毒劑,主要包括一氯氨、二氯氨和三氯氨(NH2Cl、NHCl2和NCl3),副產物少于其它水消毒劑。
(1)工業上可利用反應2Cl2(g)+NH3(g)![]() NHCl2 (l)+2HCl(g)制備二氯胺。
NHCl2 (l)+2HCl(g)制備二氯胺。
①二氯氨在中性、酸性環境中會發生強烈水解,生成具有強殺菌作用的物質,寫出具有強殺菌作用的物質的電子式_______________________。
②在恒溫條件下,將2molCl2和1molNH3充入某密閉容器中發生上述反應,測得平衡時Cl2和HCl的物質的量濃度與平衡總壓的關系如圖所示。則A、B、C三點中Cl2轉化率最高的是________點( 填“A” “B”或“C”);計算C點時該反應的壓強平衡常數Kp(C)=_____________(Kp是平衡分壓代替平衡濃度計算,分壓= 總壓×物質的量分數。)

(2)用Cl2和NH3反應制備三氯胺的方程式為3Cl2(g)+NH3(g)![]() NCl3(l)+3HCl(g),向容積均為1L的甲、乙兩個恒溫(反應溫度分別為400℃、T℃)容器中分別加入2molCl2和2molNH3,測得各容器中n(Cl2)隨反應時間t的變化情況如下表所示:
NCl3(l)+3HCl(g),向容積均為1L的甲、乙兩個恒溫(反應溫度分別為400℃、T℃)容器中分別加入2molCl2和2molNH3,測得各容器中n(Cl2)隨反應時間t的變化情況如下表所示:
t /min | 0 | 40 | 80 | 120 | 160 |
n(Cl2)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(Cl2)(乙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①T℃__________400℃(填“>”或“<”)。
②該反應的ΔH__________0(填“>”或“<”)。
③該反應自發進行的條件是__________(填高溫、低溫、任何溫度)。
④對該反應,下列說法正確的是_________(填選項字母)。
A.若容器內氣體密度不變,則表明反應達到平衡狀態
B.若容器內Cl2和NH3物質的量之比為3∶1,則表明反應達到平衡狀態
C.反應達到平衡后,其他條件不變,在原容器中按![]() =
=![]() 繼續充入一定量反應物,達新平衡后Cl2的轉化率增大
繼續充入一定量反應物,達新平衡后Cl2的轉化率增大
D.反應達到平衡后,其他條件不變,加入一定量的NC13,平衡將向逆反應方向移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(8分).氮化硅(Si3N4)是一種高溫陶瓷材料,它的硬度大、熔點高、化學性質穩定,工業上普遍采用高純硅與純氮在1300℃反應獲得。
(1)根據性質,推測氮化硅陶瓷的用途是 。
A.制汽輪機葉片 | B.制有色玻璃 | C.制永久性模具 | D.制造柴油機 |
(2)氮化硅陶瓷抗腐蝕能力強,除氫氟酸外,她不與其他無機酸反應。試推測該陶瓷被氫氟酸腐蝕的化學方程式為 。
(3)現用四氯化硅和氮氣在氫氣中加強熱發生反應,可制得高純度氮化硅,反應的化學方程式為 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com