
| 砝碼質量/g | 50 | 20 | 20 | 10 | 5 |
| 稱量(取用砝碼過程) |
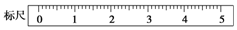
分析 (1)依據m=CVM計算溶質的質量;
(2)托盤天平的精確度為0.1g,分度盤的指針偏右,說明右邊重,將左邊的橫梁螺絲往外調調節平衡;根據使用托盤天平時,加砝碼的正確操作完成;
(3)配制一定物質的量濃度溶液一般步驟為:計算、稱量、溶解、冷卻、移液、洗滌、定容、搖勻,據此排序;
(4)分析操作對溶質的物質的量或對溶液的體積的影響,根據c=$\frac{n}{V}$分析判斷.
解答 解:(1)配制500mL 0.5mol/L的NaOH溶液,需要溶質的質量m=0.5mol/L×0.5L×40g/mol=10.0g,
故答案為:10.0g;
(2)分度盤的指針偏右,說明右邊重,左盤高于右盤.應將左邊的橫梁螺絲往外調以調節平衡.托盤天平的精確度為0.1g,故應為32.6g;根據先加質量大的砝碼,再加小的砝碼原則,先選擇50g砝碼,質量偏大,再換20g砝碼,砝碼質量不足,再加20g砝碼,砝碼質量偏大,再用10g砝碼,砝碼質量不足,增加5g砝碼,砝碼質量偏大,再調節右碼到2.2g,
故答案為:高于;將左邊的平衡螺母左旋移動,或將右邊的平衡螺母左旋,直至天平平衡;32.6g;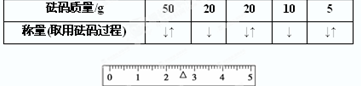 ;
;
(3)配制一定物質的量濃度溶液一般步驟為:計算、稱量、溶解、冷卻、移液、洗滌、定容、搖勻,所以正確的操作順序為:①③④②⑤;
故答案為:①③④②⑤;
(4)實際配制NaOH溶液的濃度0.48mol•L-1,所配溶液濃度偏低.
A. 用濾紙稱量時,濾紙會吸附氫氧化鈉,所以轉入燒杯的氫氧化鈉也少了,所配溶液濃度偏低.
B. 最后需要定容,容量瓶不干燥,含有少量蒸餾水,對溶液濃度無影響;
C. 未洗滌液燒杯、玻璃棒,移入容量瓶中氫氧化鈉的實際質量減小,溶液濃度偏低;
D.定容時仰視刻度,使溶液的體積偏大,所配溶液濃度偏低;
故選:ACD.
點評 本題考查了一定物質的量濃度溶液的配制,注意從c=$\frac{n}{V}$理解配制原理,注意腐蝕性易潮解的藥品應放在玻璃器皿內稱量.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
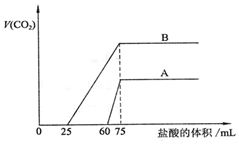 取等物質的量濃度的NaOH溶液兩份A和B,每份50mL,向其中各通入一定量的CO2,然后各取溶液10mL,分別將其稀釋為100mL,再分別向稀釋后的溶液中逐滴加入0.1mol/L的鹽酸,標準狀況下產生的CO2氣體體積與所加鹽酸體積之間的關系如圖所示,試回答下列問題:
取等物質的量濃度的NaOH溶液兩份A和B,每份50mL,向其中各通入一定量的CO2,然后各取溶液10mL,分別將其稀釋為100mL,再分別向稀釋后的溶液中逐滴加入0.1mol/L的鹽酸,標準狀況下產生的CO2氣體體積與所加鹽酸體積之間的關系如圖所示,試回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1.2mol | B. | 2mol | C. | 0.8mol | D. | 1.8mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 圖乙中Y表示ⅡA元素的價電子數 | |
| B. | 圖丁中Y表示ⅦA元素氫化物的沸點 | |
| C. | 圖丙中Y表示第三周期元素的最高正化合價 | |
| D. | 圖甲中Y表示F-、Na+、Mg2+、Al3+四種離子的半徑 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 實驗事實 | 結論 |
| A | 其他條件相同,Na2S2O3溶液濃度越大,與同濃度的硫酸反應析出流沉淀所需的時間越短 | 當其他條件不變時,增大反應物濃度,化學反應速率增大 |
| B | 用銅作電極電解CuSO4溶液,CuSO4溶液濃度不變 | Cu2+沒有參與電極反應 |
| C | 在常溫下N2不能與O2反應,而白磷卻能自燃 | 氮元素的非金屬性比磷元素的弱 |
| D | 醋酸能與堿反應 | 醋酸分子一定不能存在于堿性溶液中 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| X | Y | ||
| Z | W |
| A. | 元素的最高化合價Z大于Y | |
| B. | 元素的氣態氫化物的穩定性W強于Y | |
| C. | 原子半徑Z比Y小 | |
| D. | 元素的最高價氧化物的水化物酸性X大于W |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com