
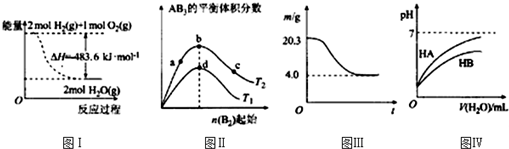
| A. | 圖Ⅰ表示H2與O2發生反應過程中的能量變化,則H2的燃燒熱△H=-241.8 kJ•mol-1 | |
| B. | 圖Ⅱ表示反應A2(g)+3B2(g)?2AB3(g),達到平衡時A2的轉化率大小為:b>a>c | |
| C. | 圖Ⅲ表示0.1mol MgCl2•6H2O在空氣中充分加熱時固體質量隨時間的變化 | |
| D. | 圖Ⅳ表示常溫下,稀釋HA、HB兩種酸的稀溶液時,溶液pH隨加水量的變化,則NaA溶液的pH大于同濃度NaB溶液的pH |
分析 A、燃燒熱是1mol可燃物完全反應生成穩定氧化物放出的熱量;
B.對于可逆反應來說,增大一種反應物的物質的量或濃度,有利于平衡向正反應方向移動,則另一種反應物的轉化率增大;
C.MgCl2為強酸弱堿鹽,在空氣中加熱發生水解生成氧化鎂,據此解答即可;
D.酸性越弱對應鹽的水解顯堿性,水解程度越大,溶液pH越大.
解答 解:A、圖象中1mol氫氣完全燃燒生成的是水蒸氣時放熱241.8kJ,不是氫氣的燃燒熱,故A錯誤;
B.根據圖象可知,a、b、c各點中B的起始物質的量依次增大,對于可逆反應來說,增大一種反應物的物質的量或濃度,有利于平衡向正反應方向移動,則另一種反應物的轉化率增大,則達到平衡時A2的轉化率大小為:a<b<c,故B錯誤;
C.MgCl2為強酸弱堿鹽,在空氣中加熱發生水解生成氧化鎂,0.1molMgO的質量為0.1mol×(24+16)g/mol=4.0g,故最終生成質量應為4.0g,故C正確;
D.稀釋HA、HB兩種酸的稀溶液時,溶液pH隨加水量的變化HA溶液PH變化大,故酸性HA>HB,則同濃度的鈉鹽,水解程度:NaA<NaB,所以同濃度的NaA溶液的pH小于NaB溶液,故D錯誤;
故選C.
點評 本題主要考查的是化學反應的能量變化規律、弱電解質的電離、平衡移動方向判斷等知識,題目難度中等,綜合性較強,充分考查了學生的靈活應用能力,注意熟練掌握弱電解質的電離平衡、化學平衡的影響因素,明確化學反應與能量變化的關系.


科目:高中化學 來源: 題型:選擇題

| A. | 維生素A的一個分子中有五個雙鍵 | |
| B. | 維生素A是一種烯烴 | |
| C. | 維生素A能使溴水褪色,能被酸性KMnO4氧化 | |
| D. | 維生素A的一個分子中有30個氫原子 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 實驗操作與現象 | 解釋或結論 |
| A | 過量的鐵粉中加入稀硝酸中,充分反應后,滴入KSCN溶液,溶液呈紅色 | 稀硝酸將Fe氧化為Fe3+ |
| B | AgI固體中滴入KCl溶液,沉淀由黃色變為白色 | AgI比AgCl難溶 |
| C | 鋁箔插入稀硝酸中,無現象 | 鋁箔表面被硝酸氧化,形成致密的氧化膜 |
| D | 苯酚溶液中滴加溴水,出現白色沉淀 | 苯酚易發生取代反應 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氯元素的相對原子質量為$\frac{12b}{a}$ | |
| B. | mg該氯原子的物質的量一定是$\frac{m}{(a{N}_{A})}$mol | |
| C. | 該氯元素的摩爾質量是aNA | |
| D. | ng該氯原子所含的電子數為$\frac{n}{a}$ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.1mol 對苯二甲酸中含有雙鍵的數目為0.2NA | |
| B. | 標準狀況下,11.2 L甲醛所含的σ鍵數目為2NA | |
| C. | 2mol NO和1mol O2混合,在密閉容器中充分反應后,容器內的分子數等于2NA | |
| D. | 1mol Fe 與足量的硝酸反應,轉移的電子數為0.2NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 (g)△H=-106kJ•mol-1
(g)△H=-106kJ•mol-1 +AgO 快
+AgO 快| A. | 反應的活化能等于106kJ•mol-1 | |
| B. | AgO2也是反應的催化劑 | |
| C. | 增大乙烯濃度能顯著提高環氧乙烷的生成速率 | |
| D. | 理論上0.7mol乙烯參與反應最多可得到0.6mol環氧乙烷 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 苯是1825年由俄國科學家門捷列夫發現的 | |
| B. | 苯與乙烯一樣,是很重要的化工原料,可作消毒劑、有機溶劑、洗滌劑 | |
| C. | 苯的分子式中碳原子遠沒有飽和,因此能使溴水和高錳酸鉀褪色 | |
| D. | 苯環上的碳碳鍵是一種介于單鍵和雙鍵的獨特的鍵,苯既能發生取代反應也能發生加成反應 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com