
| 陽離子 | K+ Na+ Cu2+ Al3+ |
| 陰離子 | SO42- HCO3- NO3- OH- |
分析 ①將它們溶于水后,D為藍色溶液,其他均為無色溶液,說明D中含有銅離子,為可溶性銅鹽;
②將E溶液滴入到C溶液中出現白色沉淀,繼續滴加,沉淀溶解,說明E是強堿,C中含有鋁離子,則E是NaOH;
③進行焰色反應,只有B、C為紫色(透過藍色鈷玻璃片),說明B、C中含有K元素,則C為KAl(SO4)2;
④在各溶液中加入硝酸鋇溶液,再加過量稀硝酸,A中放出無色氣體,則A中含有碳酸氫根離子,A焰色反應不是紫色,則A為NaHCO3;C、D中產生白色沉淀,則D為CuSO4;
⑤將B、D兩溶液混合,未見沉淀或氣體生成,則B為KNO3;
據此分析解答.
解答 解:①將它們溶于水后,D為藍色溶液,其他均為無色溶液,說明D中含有銅離子,為可溶性銅鹽;
②將E溶液滴入到C溶液中出現白色沉淀,繼續滴加,沉淀溶解,說明E是強堿,C中含有鋁離子,則E是NaOH;
③進行焰色反應,只有B、C為紫色(透過藍色鈷玻璃片),說明B、C中含有K元素,則C為KAl(SO4)2;
④在各溶液中加入硝酸鋇溶液,再加過量稀硝酸,A中放出無色氣體,則A中含有碳酸氫根離子,A焰色反應不是紫色,則A為NaHCO3;C、D中產生白色沉淀,則D為CuSO4;
⑤將B、D兩溶液混合,未見沉淀或氣體生成,則B為KNO3;
(1)通過以上分析知,B:KNO3,D:CuSO4,
故答案為:KNO3;CuSO4;
(2)A是NaHCO3,E是NaOH,將含1mol A的溶液與含1mol E的溶液反應生成Na2CO3和水,蒸干后僅得到一種化合物Na2CO3,故答案為:Na2CO3 ;
(3)鋁離子和少量氫氧根離子反應生成氫氧化鋁沉淀,氫氧化鋁是兩性氫氧化物,和氫氧化鈉反應生成偏鋁酸鈉,反應離子反應方程式為:Al3++3OH-═Al(OH)3↓,Al(OH)3+OH-═[Al(OH)4]-,
故答案為:Al3++3OH-═Al(OH)3↓,Al(OH)3+OH-═[Al(OH)4]-;
(4)C中含有鋁離子,鋁離子易水解生成氫氧化鋁膠體,膠體具有吸附性,能吸附水 中的懸浮物而凈水,水解反應方程式為:Al3++3H2O?Al(OH)3(膠體)+3H+,
故答案為:Al3++3H2O?Al(OH)3(膠體)+3H+.
點評 本題考查物質檢驗,涉及鹽類水解、物質判斷、氫氧化鋁兩性等知識點,明確物質性質及物質之間反應是解本題關鍵,題目難度不大.


 心算口算巧算一課一練系列答案
心算口算巧算一課一練系列答案科目:高中化學 來源: 題型:選擇題
| A. | 酸、堿、鹽都是電解質 | |
| B. | 蔗糖、酒精是非電解質 | |
| C. | 鹽酸是強電解質 | |
| D. | NH3的水溶液能導電,但NH3不是電解質 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 表示碳原子,用
表示碳原子,用  表示氧原子,用
表示氧原子,用  表示氮原子,如圖為氣體轉換的微觀過程.請你根據圖示回答下列問題:
表示氮原子,如圖為氣體轉換的微觀過程.請你根據圖示回答下列問題: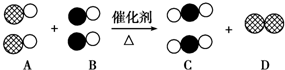
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 應量取濃鹽酸體積/mL | 應選用容量瓶的規格/mL |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 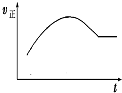 絕熱恒容密閉容器中通入A和B,發生反應:2A (g)+B (g)?2C(g),如圖為其正反應速率隨時間變化的示意圖,則該反應為放熱反應 | |
| B. | 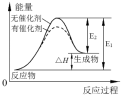 催化劑能降低反應的活化能,提高活化分子的百分含量,從而加快化學反應速率.如圖顯示的是催化反應與無催化反應過程中的能量關系 | |
| C. |  將BaO2放入密閉真空容器中,反應2BaO2(s)?2BaO(s)+O2(g)達到平衡時體系壓強為P,保持溫度不變,t0時刻將容器體積縮小為原來的$\frac{1}{2}$,體系重新達到平衡,體系壓強變化如圖所示 | |
| D. | 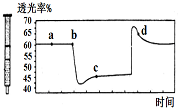 將一定量的NO2充入針筒中后封口,發生反應2NO2 (g)?N2O4(g),如圖表示在拉伸和壓縮針筒活塞的過程中氣體透光率隨時間的變化(氣體顏色越深,透光率越小).則c點與a點相比,c(NO2)增大,c(N2O4)減小. |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 2015年8月12日23:30左右,天津濱海新區的一處集裝箱碼頭發生爆炸,發生爆炸的是集裝箱內的易燃易爆物品氰化鈉,數量為700噸左右.
2015年8月12日23:30左右,天津濱海新區的一處集裝箱碼頭發生爆炸,發生爆炸的是集裝箱內的易燃易爆物品氰化鈉,數量為700噸左右.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com