
【題目】工業制膽礬時,將粗制CuO粉末(含雜質FeO、Fe2O3)慢慢加入適量的稀H2SO4中完全溶解后,除去雜質離子后,再蒸發結晶可得純凈的膽礬晶體。已知:pH≥9.6時,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4時,Cu2+以Cu(OH)2的形式完全沉淀;pH在3~4時,Fe3+以Fe(OH)3的形式完全沉淀.回答下列問題:
(1)為除去溶液中的Fe2+,可先加入______(填化學式)將Fe2+氧化為Fe3+,反應的離子方程式為__________,然后再加入適量的__________調整溶液的pH到______,使Fe3+轉化為Fe(OH)3。
(2)甲同學懷疑調整至溶液pH=4是否能達到除去Fe3+而不損失Cu2+的目的,乙同學認為可以通過計算確定,他查閱有關資料得到如下數據,常溫下Fe(OH)3的溶度積Ksp=1×10-38,Cu(OH)2的溶度積Ksp=3×10-20,通常認為殘留在溶液中的離子濃度小于1×10-5 molL-1時就認為沉淀完全,設溶液中CuSO4的濃度為3molL-1,則Cu(OH)2開始沉淀時溶液的pH為______,Fe3+完全沉淀時溶液的pH為______,通過計算確定上述方案______ (填“可行”或“不可行”)。
【答案】 H2O2 2Fe2++H2O2+2H+==2Fe3++2H2O CuO或Cu(OH)2或CuCO3或Cu2(OH)2CO3 3~4 4 3 可行
【解析】試題分析:本題以粗制CuO粉末制取純凈的膽礬晶體為載體,考查物質的分離提純,溶度積的計算。
(1)由于pH![]() 9.6時,Fe2+以Fe(OH)2的形式完全沉淀;pH
9.6時,Fe2+以Fe(OH)2的形式完全沉淀;pH![]() 6.4時,Cu2+以Cu(OH)2的形式完全沉淀;除去溶液中的Fe2+,先加入氧化劑將Fe2+氧化,為了不引入雜質,加入的氧化劑選H2O2,反應的離子方程式為2Fe2++H2O2+2H+=2Fe3++2H2O。pH在3~4時,Fe3+以Fe(OH)3的形式完全沉淀,為了不引入雜質,然后加入適量的CuO(或Cu(OH)2、CuCO3、Cu2(OH)2CO3)調整溶液的pH至3~4,使Fe3+完全轉化為Fe(OH)3沉淀。
6.4時,Cu2+以Cu(OH)2的形式完全沉淀;除去溶液中的Fe2+,先加入氧化劑將Fe2+氧化,為了不引入雜質,加入的氧化劑選H2O2,反應的離子方程式為2Fe2++H2O2+2H+=2Fe3++2H2O。pH在3~4時,Fe3+以Fe(OH)3的形式完全沉淀,為了不引入雜質,然后加入適量的CuO(或Cu(OH)2、CuCO3、Cu2(OH)2CO3)調整溶液的pH至3~4,使Fe3+完全轉化為Fe(OH)3沉淀。
(2)常溫下,Cu(OH)2開始沉淀時c(Cu2+)·c2(OH-)=Ksp[Cu(OH)2]=3![]() 10-20,c(OH-)=
10-20,c(OH-)=![]() =1
=1![]() 10-10mol/L,c(H+)=1
10-10mol/L,c(H+)=1![]() 10-4mol/L,Cu(OH)2開始沉淀時溶液的pH=4。Fe3+完全沉淀時c(Fe3+)
10-4mol/L,Cu(OH)2開始沉淀時溶液的pH=4。Fe3+完全沉淀時c(Fe3+)![]() 1
1![]() 10-5mol/L,c(Fe3+)·c3(OH-)=Ksp[Fe(OH)3]=1
10-5mol/L,c(Fe3+)·c3(OH-)=Ksp[Fe(OH)3]=1![]() 10-38,c(OH-)=
10-38,c(OH-)=![]() =1
=1![]() 10-11mol/L,c(H+)=1
10-11mol/L,c(H+)=1![]() 10-3mol/L,Fe3+完全沉淀時溶液的pH=3。根據計算結果知上述方案可行。
10-3mol/L,Fe3+完全沉淀時溶液的pH=3。根據計算結果知上述方案可行。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】下列說法中正確的是
A.把煤粉碎了再燃燒可以提高煤的燃燒效率
B.增加煉鐵高爐的高度可以降低尾氣中CO的含量
C.無論加入正催化劑還是加入負催化劑都能大大提高化學反應速率
D.用完的電池可以隨意地丟棄
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鉑(Pt)可以和很多化合物形成配合物,生產生活中有重要的用途。
(1)鉑和氨水可以形成配合物。可用于提取鉑。氨水中各元素的第一電離能由大到小的順序___。
(2)二氯二吡啶合鉑是由Pt2+、Cl-和吡啶結合形成的鉑配合物,有順式和反式兩種同分異構體,科學研究表明,反式分子和順式分子一樣具有抗癌活性。
①C1-的核外電子排布式為_______。
②吡啶分子是大體積平面配體,其結構簡式為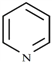 ,吡啶分子中氮原子的軌道雜化方式是_____,分子中的大π鍵可用符號
,吡啶分子中氮原子的軌道雜化方式是_____,分子中的大π鍵可用符號![]() 表示,其中m代表參與形成大π鍵的原子數,n代表參與形成大π鍵的電子數,則吡啶中的大π鍵應表示為_____;1mol吡啶中含有σ鍵的數目為________
表示,其中m代表參與形成大π鍵的原子數,n代表參與形成大π鍵的電子數,則吡啶中的大π鍵應表示為_____;1mol吡啶中含有σ鍵的數目為________
③二氯二吡啶合鉑分子中存在的微粒間作用力有_____(填字母)。
a.離子健 b.配位鍵c.金屬鍵 d.非極性鍵e.氫鍵f.極性鍵
④二氯二吡啶合鉑分子中,Pt2+的配位數是4,但是其軌道雜化方式并不是sp3。簡述理由_____________。
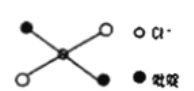
⑤反式二氯二吡啶合鉑分子結構如圖所示,該分子是_____分子(其“極性”或“非極性”)。
(3)富勒烯C60能夠與Pt結合形成一系列絡合物。富勒烯(C60)的結構如圖所示,C60屬于____晶體;C60分子中五元環與六元環的數目比為__________。
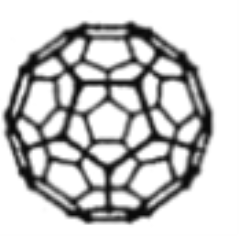
(已知簡單多面體的頂點數V、棱數E及面數F間有如下關系:V-E+F=2)。
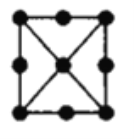
(4)金屬鉑立方晶胞的二維投影圖如圖所示。若金屬鉑的密度dg/cm3,則晶胞參數a=___nm(列出計算式即可)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碳及其化合物在有機合成、能源開發等工農業方面具有十分廣泛的應用。
I.工業生產精細化工產品乙二醛(OHC-CHO)
(1)乙醇(CH3CH2OH)液相硝酸氧化法:在Cu(NO3)2催化下,用稀硝酸氧化乙醇制取乙二醛,此反應的化學方程式為_______________。該法具有原料易得、反應條件溫和等優點,但也存在比較明顯的缺點____________。
(2)乙二醇(HOCH2CH2OH)氣相氧化法
已知:2H2(g)+O2(g) ![]() 2H2O(g)ΔH=-484kJ/mol,化學平衡常數為K1
2H2O(g)ΔH=-484kJ/mol,化學平衡常數為K1
OHC-CHO(g)+2H2(g) ![]() HOCH2CH2OH(g) ΔH=-78kJ/mol,化學平衡常數為K2
HOCH2CH2OH(g) ΔH=-78kJ/mol,化學平衡常數為K2
則乙二醇氣相氧化反應HOCH2CH2OH(g)+O2(g) ![]() OHC-CHO(g)+2H2O(g)的ΔH=______;相同溫度下,該反應的化學平衡常數K=______(用含K1、K2的代數式表示)。
OHC-CHO(g)+2H2O(g)的ΔH=______;相同溫度下,該反應的化學平衡常數K=______(用含K1、K2的代數式表示)。
Ⅱ.CO2的綜合利用
(3)一定量的CO2與足量的碳在體積可變的恒壓密閉容器中發生反應C(s)+CO2(g)![]() 2CO(g)。平衡時,體系中氣體體積分數與溫度的關系如下圖所示,則下列說法正確的是______(填字母)。
2CO(g)。平衡時,體系中氣體體積分數與溫度的關系如下圖所示,則下列說法正確的是______(填字母)。
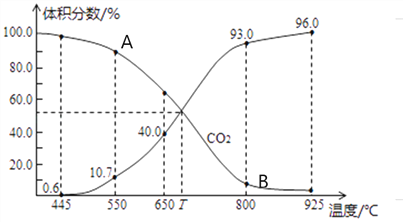
a.反應達平衡狀態時,混合氣體的平均相對分子質量保持不變
b.A點的正反應速率比B點正反應速率小
C.550℃時,若充入氦氣,則V正、V逆均減小,平衡不移動
d.T℃時,反應達平衡后CO2的轉化率為66.7%
e. T℃時,若再充入1molCO2和1molCO,平衡不移動
(4)氨氣、CO2在一定條件下可合成尿素,其反應為2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g),右圖表示合成塔中氨碳比a與CO2轉化率ω的關系。a為{n(NH3)/n(CO2)},b為水碳比{n(H2O)/n(CO2)}。則
CO(NH2)2(s)+H2O(g),右圖表示合成塔中氨碳比a與CO2轉化率ω的關系。a為{n(NH3)/n(CO2)},b為水碳比{n(H2O)/n(CO2)}。則
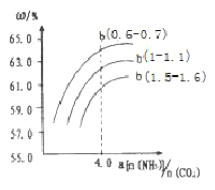
①b應控制在______
a.1.5-1.6b.1-1.1c.0.6-0.7
②a應控制在4.0的理由是_________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在正規化學試卷的開始處總有“可能用到的相對原子質量”一項,如H:1 C:12 Cl:35.5 S:32 Cu:64等.請問這些數值準確的說法應該是( )
A.某種核素的相對原子質量
B.某種核素的近似相對原子質量
C.某種元素的平均相對原子質量
D.某種元素的平均相對原子質量的近似值
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,取0.1mol/L的NaA和NaB兩種鹽溶液各1L,分別通入0.02molCO2,發生如下反應:NaA+CO2+H2O=HA+NaHCO3、2NaB+CO2+H2O=2HB+Na2CO3。HA和HB的1L溶液分別加水稀釋至體積為VL時可能有如圖曲線,則下列說法正確的是
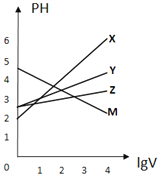
A. 相同條件下,對于c(R-)/[c(HR)·c(OH-)]的值(R代表A或B),一定存在HA>HB
B. 常溫下pH:NaA溶液>NaB溶液
C. X是HA,M是HB
D. 若常溫下濃度均為0.1mol/L的NaA和HA的溶液等體積混合,則c(A-)+c(HA)=0.2mol/L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】電解原理和原電池原理是電化學的兩個重要內容.某興趣小組做如下探究實驗:

(1)如圖1為某實驗小組依據氧化還原反應設計的原電池裝置,該反應的離子方程式為__________________,反應前兩電極質量相等,一段時間后,兩電極質量相差15g,導線中通過__mol電子.
(2)如圖1,其他條件不變,若將CuCl2溶液換為NH4Cl溶液,石墨電極的電極反應式為___________________________________,這是由于NH4Cl溶液顯____性,用離子方程式表示溶液顯此性的原因__________________________________________
(3)如圖2,其他條件不變,若將鹽橋換成彎銅導線與石墨相連成∩型,則乙裝置中石墨電極(1)為__極,甲裝置中銅電極上電極反應式為_____

(4)如圖2乙裝置中改為加入400mL CuSO4溶液,一段時間后,若電極質量增重1.28g,則此時溶液的pH為__
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)儲氫納米碳管的研究成功體現了科技的進步,但用電孤法合成的碳納米管常伴有大量的雜質-碳納米顆粒,可用氧化氣化法提純。其反應式為:3C+2K2Cr2O7 + 8H2SO4= 3CO2 + 2K2SO4+ 2Cr2(SO4)3 + 8H2O
①請用雙線橋法標出電子轉移方向和數目__________________________________
②上述反應中氧化劑是___________________(填化學式)。
(2)按如圖所示操作,充分反應后:

①Ⅰ中發生反應的離子方程式為_________________________________________
②結合Ⅰ、Ⅱ實驗現象可知Fe2+、Cu2+、Ag+的氧化性由強到弱的順序為___________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某學習小組對某葡萄酒中SO2的含量進行檢測,按下圖連接好儀器。回答下列問題:

Ⅰ.樣品蒸餾
取20.00mL樣品和250 mL水置于儀器A中,儀器B是去掉塞子的碘量瓶,向其中裝人25mL 乙酸鉛溶液,然后向儀器A中加入10 mL鹽酸,立即蓋塞蒸餾;當碘量瓶中的液體約200 mL時,將插入碘量瓶液面下的導管向上提起并將導管置于液面上方1cm 處,再蒸餾2min左右;最后用少量蒸餾水沖洗碘量瓶中的導管,并將沖洗液并入碘量瓶中。同時做空白實驗(即不加樣品情況下按同法操作,防止實驗誤差)。
已知:SO2+H2O+Pb(CH3COO)2=PbSO3↓+2CH3COOH。
(1)儀器A 的名稱是_________________ 。
(2)實驗中使用的碘量瓶最適宜的規格是_________ (填標號)。
a.100 mL b.250 mL c.500 mL d.1000 mL
(3)如果實驗最后未用少量蒸餾水沖洗碘量瓶中的導管,會導致測定結果__________(填“偏高”“ 偏低”或“不影響”)。
Ⅱ.滴定操作
向取下的碘量瓶中加入10 mL鹽酸和1mL淀粉溶液,搖勻后用0.01mol·L-1的碘標準溶液滴定,記錄消耗的碘標準溶液的體積為V( 單位為mL)。
(4)滴定終點的現象是_____________________,該滴定反應的離子方程式是______________。
Ⅲ.結果分析
(5)甲組4 次實驗測得V分別為
實驗 | 1 | 2 | 3 | 4 |
V/mL | 9.98 | 12.00 | 10.02 | 10.00 |
據此可計算此葡萄酒中SO2的含量為_______mg·L-1
乙組認為甲組實驗不嚴謹,可能會有誤差,因為甲組未做_____________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com