
| A. | CO32- | B. | OH- | C. | Al3+ | D. | Ag+ |
分析 溶液中存在大量的NH4+、C1-、Ca2+,與NH4+反應的離子不能大量共存,與Ca2+結合生成沉淀的離子不能共存,根據離子之間結合生成沉淀、氣體、水、弱電解質等,則離子不能大量共存,以此解答.
解答 解:A.CO32- 離子結合Ca2+生成碳酸鈣沉淀,Ca2++CO32-=CaCO3↓,故A不符合;
B.OH-離子和NH4+離子結合生成一水合氨,.OH-+NH4+=NH3•H2O,不能大量共存,故B不符合;
C.Al3+和NH4+、C1-、Ca2+離子都不發生反應,可以共存,故C符合;
D.銀離子會結合氯離子生成白色沉淀氯化銀,Ag++Cl-=AgCl↓,不能大量共存,故D不符合;
故選C.
點評 本題考查離子的共存,為高頻考點,把握習題中的信息及常見離子之間的反應為解答的關鍵,側重復分解反應的離子共存考查,題目難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | 由H+(aq)+OH-(aq)=H20(1)△H=-57.3 kJ•mol-1,可知含1 mo1 HCl的溶液與1 mol NaOH固體混合,放出熱量大于57.3 kJ | |
| B. | 由C(石墨)=C(金剛石)△H=+1.9 kJ•mol-1,可知石墨沒有金剛石穩定 | |
| C. | 由N2(g)+3H2(g)=2NH3(g)△H=-92.4 kJ•mol-1,可知將1 mol N2(g)和3 mol H2(g)置于密閉容器中充分反應后放出熱量為92.4 kJ | |
| D. | 由△G=△H-T△S可知,所有的放熱反應都能自發進行 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,22.4L H2中所含質子數、中子數均為2NA | |
| B. | 46g NO2氣體和46g N2O4氣體的分子數之比為2:1 | |
| C. | 1L 1 mol•L-1的鹽酸中所含粒子總數為2NA | |
| D. | 71g氯氣與足量鐵粉充分反應,轉移的電子數為3NA |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
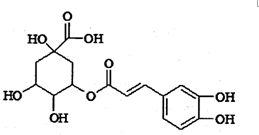 綠原酸被譽為“第七類營養素”,具有廣泛的殺菌、消炎功能,其結構簡式如圖所示.下列有關綠原酸的說法中正確的是( )
綠原酸被譽為“第七類營養素”,具有廣泛的殺菌、消炎功能,其結構簡式如圖所示.下列有關綠原酸的說法中正確的是( )| A. | 綠原酸分子中含有3種官能團 | |
| B. | 1 mol綠原酸最多能與7molNaOH發生反應 | |
| C. | 綠原酸能發生取代反應、加成反應和消去反應 | |
| D. | 綠原酸能使酸性高錳酸鉀溶液、濃溴水褪色,但反應原理不同 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 若銅有剩余,則向反應后的溶液中再滴加硫酸,銅也不能溶解 | |
| B. | 若金屬全部溶解,則反應后的溶液中一定含有Cu2+、Fe3+離子 | |
| C. | 若鐵粉全部轉化為Fe2+離子,則b的值為0.8 | |
| D. | 若反應后的溶液中n(Fe3+):n(Fe2+)=3:2,則產生的NO為5152 mL(標準狀況) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 回收利用金屬制品,廢舊電池專門回收處理 | |
| B. | 開發太陽能、水能、風能、可燃冰等新能源,減少使用煤、石油等化石燃料 | |
| C. | 大湖名城,水資源豐富,工業廢水和生活污水可任意排放 | |
| D. | 合肥一六八中學開展“校園文明活動”、“光盤行動”、減少使用瓶裝水 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 在如圖所示的電解質溶液的導電性裝置中,若向某-電解質溶液中逐滴加入另一種溶液時.則燈光由亮變暗至熄滅后又逐漸變亮的是( )
在如圖所示的電解質溶液的導電性裝置中,若向某-電解質溶液中逐滴加入另一種溶液時.則燈光由亮變暗至熄滅后又逐漸變亮的是( )| A. | 鹽酸中逐滴加入食鹽溶液 | B. | 醋酸中逐滴加入氫氧化鈉溶液 | ||
| C. | 氫氧化鋇溶液中逐滴加入硫酸溶液 | D. | 醋酸中逐滴加入氨水 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com