
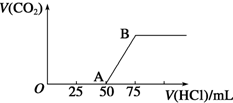
 向50mL NaOH溶液中逐漸通入一定量的CO2(假設溶液體積不變),隨后取此溶液10mL,將其稀釋至100mL,并向此稀釋后的溶液中逐滴加入0.1mol•L-1的鹽酸,產生CO2氣體的體積(標準狀況下)與所加入的鹽酸的體積關系如圖,下列分析錯誤的是( )
向50mL NaOH溶液中逐漸通入一定量的CO2(假設溶液體積不變),隨后取此溶液10mL,將其稀釋至100mL,并向此稀釋后的溶液中逐滴加入0.1mol•L-1的鹽酸,產生CO2氣體的體積(標準狀況下)與所加入的鹽酸的體積關系如圖,下列分析錯誤的是( )| A. | OA段所發生反應的離子方程式:H++OH-═H2O | |
| B. | NaOH在吸收CO2后,所得溶液的溶質為NaOH和Na2CO3,其物質的量濃度之比為1:1 | |
| C. | 產生的CO2體積(標準狀況下)為0.056 L | |
| D. | 原NaOH溶液的物質的量濃度為0.5 mol•L-1 |
分析 當生成CO2氣體時,發生反應:NaHCO3+HCl=NaCl+H2O+CO2↑,由圖可知,生成CO2氣體至最大,消耗HCl為25mL,若二氧化碳與NaOH反應后溶液中只有Na2CO3,由Na2CO3+HCl=NaHCO3+NaCl可知,將Na2CO3轉化為NaHCO3應消耗HCl為25mL,而圖象中開始生成CO2氣體時消耗HCl體積為50mL,說明該階段還發生反應:NaOH+HCl=NaCl+H2O,溶液中溶質為NaOH、Na2CO3.
A.根據發生的反應書寫離子方程式;
B.中和NaOH消耗HCl的體積為50mL-25mL=25mL,根據反應消耗鹽酸的體積計算NaOH、Na2CO3的物質的量之比;
C.生成二氧化碳消耗消耗25mL鹽酸,根據NaHCO3+HCl=NaCl+H2O+CO2↑計算二氧化碳體積;
D.生成CO2氣體最大時,此時溶液中溶質為NaCl,根據鈉離子、氯離子守恒可知n(NaOH)=n(NaCl)=n(HCl),進而計算氫氧化鈉的濃度.
解答 解:當生成CO2氣體時,發生反應:NaHCO3+HCl=NaCl+H2O+CO2↑,由圖可知,生成CO2氣體至最大,消耗HCl為25mL,若二氧化碳與NaOH反應后溶液中只有Na2CO3,由Na2CO3+HCl=NaHCO3+NaCl可知,將Na2CO3轉化為NaHCO3應消耗HCl為25mL,而圖象中開始生成CO2氣體時消耗HCl體積為50mL,說明該階段還發生反應:NaOH+HCl=NaCl+H2O,溶液中溶質為NaOH、Na2CO3.
A.由上述分析可知,OA段所發生反應的離子方程式:H++OH-═H2O、CO32-+H+═HCO3-,故A錯誤;
B.中和NaOH消耗HCl的體積為50mL-25mL=25mL,由方程式可知NaHCO3和Na2CO3的物質的量之比等于兩個過程分別消耗鹽酸的體積之比,故NaOH、Na2CO3的物質的量之比=25mL:25mL=1:1,故B正確;
C.生成二氧化碳消耗消耗25mL鹽酸,根據NaHCO3+HCl=NaCl+H2O+CO2↑,可知CO2體積(標準狀況下)為0.025L×0.1mol/L×22.4L/mol=0.056L,故C正確;
D.生成CO2氣體最大時,此時溶液中溶質為NaCl,根據鈉離子、氯離子守恒可知n(NaOH)=n(NaCl)=n(HCl)=0.075L×0.1mol/L=0.0075mol,故原氫氧化鈉溶液的濃度=$\frac{0.0075mol}{0.01L}$=0.75mol/L,故D錯誤,
故選:AD.
點評 本題考查混合物計算,根據消耗鹽酸的體積判斷圖象中各階段發生的反應是解答的關鍵,側重考查學生分析思維能力,難度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | HCO${\;}_{3}^{-}$═CO${\;}_{3}^{2-}$+H+ | B. | NaHSO4═Na++HSO4- | ||
| C. | H3PO4?3H++PO${\;}_{4}^{3-}$ | D. | NH3•H2O?NH${\;}_{4}^{+}$+OH- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1.4 g | B. | 2.2 g | C. | 4.4 g | D. | 在2.2~4.4 g之間 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 實驗室制乙烯時,在酒精和濃硫酸的混合液中,放入幾片碎瓷片,加熱混合物,使液體溫度迅速升到170℃ | |
| B. | 實驗室制取肥皂時,待植物油、乙醇和氫氧化鈉溶液的混合物加熱充分反應后,冷卻,用紗布濾出固態物質 | |
| C. | 驗證溴乙烷水解產物時,將溴乙烷和氫氧化鈉溶液混合,充分振蕩溶液、靜置,待液體分層后,滴加硝酸銀溶液 | |
| D. | 驗證蔗糖水解產物時,在蔗糖溶液中加入幾滴稀硫酸,水浴5 min,加入新制銀氨溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com