
| 實驗序號 | 甲 | 乙 | 丙 |
| 合金質量/mg | 255 | 385 | 459 |
| 生成氣體體積/mL | 280 | 336 | 336 |
分析 (1)鹽酸濃度、體積一定,甲中合金質量小于乙中合金質量,且甲中生成氣體體積小于乙中氣體體積,說明甲中鹽酸過量、金屬完全反應;根據甲中金屬與氫氣的體積定比關系計算生成336mL氫氣需要金屬的質量,確定乙中鹽酸與金屬是否恰好反應;
(2)乙、丙中鹽酸完全,可以根據反應生成氫氣體積計算鹽酸的物質的量濃度,根據n=$\frac{V}{{V}_{m}}$計算氫氣的物質的量,根據氫元素守恒可知n(HCl)=2n(H2),據此計算;
(3)甲中鹽酸有剩余,金屬完全反應,此時生成氫氣280mL,故可以根據甲組數據計算金屬的物質的量之比,設鎂、鋁的物質的量分別為xmol、ymol,根據二者質量之和與電子轉移守恒列方程計算x、y的值,據此解答.
解答 解:(1)鹽酸濃、體積一定,甲中合金質量小于乙中合金質量,且甲中生成氣體體積小于乙中氣體體積,說明甲中鹽酸過量、金屬完全反應,乙中合金質量小于丙中合金質量,且乙、丙生成氣體體積相等,說明乙、丙中鹽酸完全反應,
根據甲可知,生成336mL氫氣需要金屬的質量為:255mg×$\frac{336mL}{280mL}$=306mg,故乙中金屬有剩余,乙中鹽酸不足,
故答案為:乙;因甲反應后的溶液中再加合金還能繼續反應,說明甲中鹽酸有剩余,若乙中鹽酸恰好完全反應或有剩余,則產生的氫氣應為$\frac{280}{255}$385 mL=423 mL>336 mL,故說明乙中鹽酸不足;
(2)乙、丙中鹽酸完全反應,可以根據反應生成氫氣體積計算鹽酸的物質的量濃度,鹽酸完全反應生成氫氣336mL,氫氣的物質的量為:$\frac{0.336L}{22.4L/mol}$=0.015mol,根據氫元素守恒可知:n(HCl)=2n(H2)=2×0.015mol=0.03mol,故鹽酸的物質的量濃度為:$\frac{0.03mol}{0.03L}$=1mol/L,
故答案為:1mol/L;
(3)甲中鹽酸有剩余,金屬完全反應,此時生成氫氣280mL,故可以根據甲組數據計算金屬的物質的量之比,設鎂、鋁的物質的量分別為xmol、ymol,根據二者質量可知:①24x+27y=0.255,根據電子轉移守恒有:②2x+3y=$\frac{0.28L}{22.4L/mol}$×2,
根據①②聯立解得:x=0.005、y=0.005,
所以合金中鎂與鋁的物質的量之比為:0.005mol:0.005mol=1:1,
故答案為:1:1.
點評 本題考查混合物反應的計算,題目難度中等,根據表中數據關系判斷反應的過量問題是關鍵,注意掌握守恒思想在化學計算中的應用方法,試題培養了學生的分析、理解能力及化學計算能力.


科目:高中化學 來源: 題型:解答題

 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用Na、Mg分別與冷水反應的實驗來證明Na、Mg的金屬性強弱 | |
| B. | 用MgCl2和AlCl3分別與過量氨水反應的實驗證明Mg、Al的金屬性強弱 | |
| C. | 用MgCl2和AlCl3分別與過量NaOH溶液逐步反應的實驗證明Mg、Al的金屬性強弱 | |
| D. | 用Mg(OH)2和Al(OH)3分別與強堿反應的實驗來證明Mg、Al的金屬性強弱 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫時,在水中的溶解性:碳酸鈉>碳酸氫鈉 | |
| B. | 熱穩定性:碳酸鈉<碳酸氫鈉 | |
| C. | 質量相同時,分別與同體積同濃度鹽酸反應的快慢:碳酸鈉>碳酸氫鈉 | |
| D. | 物質的量相同時,分別與足量的鹽酸反應,生成CO2的質量:碳酸鈉<碳酸氫鈉 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
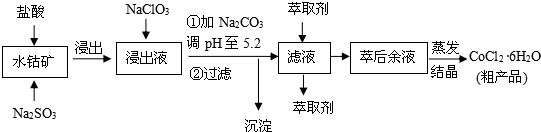
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 開始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com