
| A. | H${\;}_{2}^{18}$O中投入Na2O2固體:2H${\;}_{2}^{18}$O+2O${\;}_{2}^{2-}$═4OH-+18O2↑ | |
| B. | 向0.1 mol•L-1、pH=1的NaHA溶液中加入NaOH溶液:H++OH-═H2O | |
| C. | 以金屬銀為陽極電解飽和硫酸銅溶液:Cu2++2H2O═2Cu+O2↑+4H+ | |
| D. | NH4Al(SO4)2溶液中加入Ba(OH)2溶液SO42-使完全沉淀:Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O |
分析 A.過氧化鈉在離子反應中保留化學式;
B.向0.1 mol•L-1、pH=1的NaHA溶液完全電離出氫離子;
C.以金屬銀為陽極電解飽和硫酸銅溶液,陽極Ag失去電子;
D.加入Ba(OH)2溶液SO42-使完全沉淀,反應生成硫酸鋇、氫氧化鋁和一水合氨.
解答 解:A.H${\;}_{2}^{18}$O中投入Na2O2固體的離子反應為2H${\;}_{2}^{18}$O+2Na2O2═4Na++2OH-+218OH-+O2↑,故A錯誤;
B.向0.1 mol•L-1、pH=1的NaHA溶液中加入NaOH溶液的離子反應為H++OH-═H2O,故B正確;
C.以金屬銀為陽極電解飽和硫酸銅溶液的離子反應為Cu2++2Ag$\frac{\underline{\;電解\;}}{\;}$2Cu+2Ag+,故C錯誤;
D.NH4Al(SO4)2溶液中加入Ba(OH)2溶液SO42-使完全沉淀的離子反應為NH4++Al3++2SO42-+2Ba2++4OH-═Al(OH)3↓+2BaSO4↓+NH3.H2O,故D錯誤;
故選B.
點評 本題考查離子反應方程式書寫的正誤判斷,為高頻考點,把握發生的反應及離子反應的書寫方法為解答的關鍵,側重復分解反應及氧化還原反應的考查,注意離子反應中保留化學式的物質及電子、電荷守恒,題目難度不大.


科目:高中化學 來源: 題型:解答題
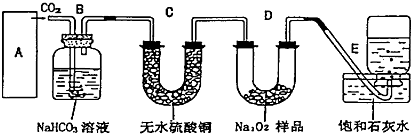

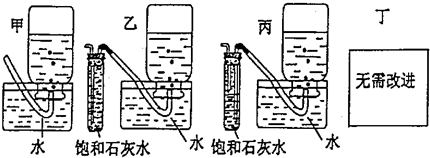
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 離子化合物Y(XO3)2 | B. | 離子化合物Y2X3 | C. | 共價化合物Y3X2 | D. | 共價化合物XY2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
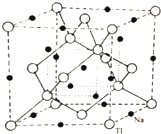 ⅢA族的硼、鋁、鎵、銦、鉈等元素在化合物中通常表現出+3價,含ⅢA族元素的化合物在研究和生產中有許多重要用途.請回答下列問題.
ⅢA族的硼、鋁、鎵、銦、鉈等元素在化合物中通常表現出+3價,含ⅢA族元素的化合物在研究和生產中有許多重要用途.請回答下列問題.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
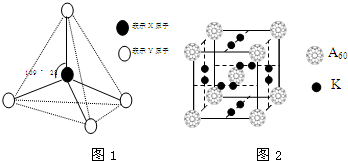 現有A、B、C、D、E、F六種物質或粒子,其中A、B、C、D都具有如圖1所示的結構或結構單元,(圖中正四面體以外可能有的部分未畫出,虛線不表示化學鍵或分子間作用力,X、Y可以相同也可以不同).A、B的晶體類型相同.工業上利用單質A的同素異形體能與B物質發生置換反應,制取單質G的粗產品.C、D、E、F含有相等的電子數,且D是陽離子,D與F的組成元素相同.C、E、F的晶體類型相同,由E構成的物質常溫下呈液態.
現有A、B、C、D、E、F六種物質或粒子,其中A、B、C、D都具有如圖1所示的結構或結構單元,(圖中正四面體以外可能有的部分未畫出,虛線不表示化學鍵或分子間作用力,X、Y可以相同也可以不同).A、B的晶體類型相同.工業上利用單質A的同素異形體能與B物質發生置換反應,制取單質G的粗產品.C、D、E、F含有相等的電子數,且D是陽離子,D與F的組成元素相同.C、E、F的晶體類型相同,由E構成的物質常溫下呈液態. .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 近年來,我國的霧霾問題引起政府和群眾的高度關切,一般認為細顆粒物(即PM2.5,指直徑小于或等于2.5微米的顆粒物)的指標與霧霾天氣密切相關.與此同時,光化學煙霧也開始抬頭,它是由非甲烷烴和NOx的排放引起的,嚴重時天空會出現彩色云霧,屬于一種重污染現象.臭氧濃度升高是光化學煙霧形成的標志.請回答下列相關問題:
近年來,我國的霧霾問題引起政府和群眾的高度關切,一般認為細顆粒物(即PM2.5,指直徑小于或等于2.5微米的顆粒物)的指標與霧霾天氣密切相關.與此同時,光化學煙霧也開始抬頭,它是由非甲烷烴和NOx的排放引起的,嚴重時天空會出現彩色云霧,屬于一種重污染現象.臭氧濃度升高是光化學煙霧形成的標志.請回答下列相關問題:| 實驗序號 | c(NH4+)/mol•L-1 | c(NO2-)/mol•L-1 | ν/mol•L-1•s-1 |
| 1 | 0.0100 | 0.200 | 5.4×10-7 |
| 2 | 0.0200 | 0.200 | 1.08×10-6 |
| 3 | 0.200 | 0.040 | 2.16×10-6 |
| 4 | 0.200 | 0.060 | 3.24×10-6 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,2.24LCl2溶于足量水中轉移電子的數目為0.1NA | |
| B. | 標準狀況下,22.4L苯中含有雙鍵的數目為3NA | |
| C. | 常溫下,16gO2和O3的混合氣體中含有氧原子的數目為NA | |
| D. | 25℃時,pH=1的醋酸溶液中含有H+的數目為0.1NA |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com