
 ⅢA族的硼、鋁、鎵、銦、鉈等元素在化合物中通常表現出+3價,含ⅢA族元素的化合物在研究和生產中有許多重要用途.請回答下列問題.
ⅢA族的硼、鋁、鎵、銦、鉈等元素在化合物中通常表現出+3價,含ⅢA族元素的化合物在研究和生產中有許多重要用途.請回答下列問題.分析 (1)B原子核外電子數為5,根據能量最低原理書寫核外電子排布式;BF3分子中B原子形成3個B-F鍵,沒有孤對電子,雜化軌道數目為3;
(2)氯化鋁的熔沸點比較低,易溶液非金屬性溶解,應屬于分子晶體;
(3)①A.砷化鎵晶胞結構與金剛石相似,Ga原子周圍有4個As原子,雜化軌道數目為4;
B.同周期元素從左到右第一電離能呈增大趨勢,ⅡA、ⅤA族高于同周期相鄰元素的;
C.同周期元素從左到右電負性逐漸增大;
D.As、Ga分別處于VA族、ⅢA族,處于p區元素;
②砷化鎵可由(CH3)3Ga和AsH3在700℃下反應制得,根據原子守恒可知還生成CH4;
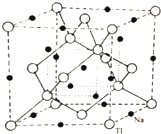
(4)根據均攤法計算晶胞中Na、Tl原子數目,確定化學式,計算晶胞質量,晶胞體內小立方體體心黑色球與小立方體頂點白色球之間距離最近,則晶胞體對角線長度為4a pm,故晶胞棱長為$\frac{4a}{\sqrt{3}}$ pm,再根據ρ=$\frac{m}{V}$計算晶胞密度.
解答 解:(1)B原子核外電子數為5,核外電子排布式為1s22s22p1;BF3分子中B原子形成3個B-F鍵,沒有孤對電子,雜化軌道數目為3,B原子采取sp2雜化,
故答案為:1s22s22p1;sp2雜化;
(2)氯化鋁的熔沸點比較低,易溶液非金屬性溶解,應屬于分子晶體,
故答案為:分子;
(3)①A.砷化鎵晶胞結構與金剛石相似,Ga原子周圍有4個As原子,雜化軌道數目為4,Ga原子的軌道雜化方式為sp3,故A正確;
B.同周期元素從左到右第一電離能呈增大趨勢,ⅡA、ⅤA族高于同周期相鄰元素的則第一電離能:As>Ga,故B錯誤;
C.同周期元素從左到右電負性逐漸增大,則電負性:As>Ga,故C錯誤;
D.As、Ga分別處于VA族、ⅢA族,處于p區元素,故D正確,
故選:AD;
②反應物為(CH3)3Ga和AsH3,生成物為GaAs,根據原子守恒可知還應生成CH4,反應的化學方程式為:(CH3)3Ga+AsH3$\stackrel{700℃}{→}$GaAs+3CH4,
故答案為:(CH3)3Ga+AsH3$\stackrel{700℃}{→}$GaAs+3CH4;
(4)根據晶胞結構圖可知,在晶胞的每個棱邊的中點上各有一個鈉離子,體心上也有一個鈉離子,在由三個相鄰的棱邊中點和體心構成的互不相鄰的四個正四面體的中心也有一個鈉離子,這樣將所有鈉離子連起來,結構與金剛石的結構相似,根據均攤法,晶胞中含有的T1的原子數為8×$\frac{1}{8}$+6×$\frac{1}{2}$+4=8、Na的個數為12×$\frac{1}{4}$+1+4=8,所以該晶胞中鈉離子和鉈離子個數為8:8=1:1,所以其化學式為NaTl;
晶胞質量為8×$\frac{23+204}{{N}_{A}}$g,晶胞體內小立方體體心黑色球與小立方體頂點白色球之間距離最近,則晶胞體對角線長度為4a pm,故晶胞棱長為$\frac{4a}{\sqrt{3}}$ pm,則晶胞密度為:8×$\frac{23+204}{{N}_{A}}$g÷($\frac{4a}{\sqrt{3}}$×10-10 cm)3=$\frac{681\sqrt{3}}{8×1{0}^{-30}×{N}_{A}×{a}^{3}}$g.cm-3,
故答案為:NaTl;$\frac{681\sqrt{3}}{8×1{0}^{-30}×{N}_{A}×{a}^{3}}$.
點評 本題考查是度物質結構與性質的考查,涉及核外電子排布、晶體類型與性質、電離能、電負性、晶胞計算等,(4)中為難點、易錯點,需要學生具備一定的空間想象與數學計算能力,關鍵是確定處于最近位置的Tl、Na原子計算晶胞棱長.


 優百分課時互動系列答案
優百分課時互動系列答案 開心蛙狀元作業系列答案
開心蛙狀元作業系列答案科目:高中化學 來源: 題型:選擇題
| A. | Na2O常用于潛水艇或呼吸面具的供氧劑 | |
| B. | 氧化鎂用作耐火材料 | |
| C. | 利用NaHCO3治療胃酸過多 | |
| D. | FeCl3溶液可用于刻制印刷銅電路板 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
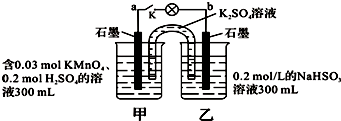
| A. | 當電路中有1.204×1022個電子轉移時,乙燒杯中溶液的C(H+)約為0.1 mol•L-1 | |
| B. | 電池工作時,鹽橋中的K+移向甲燒杯 | |
| C. | 電池工作時,外電路的電子方向是從a到b | |
| D. | 乙池中的氧化產物為SO42- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | H${\;}_{2}^{18}$O中投入Na2O2固體:2H${\;}_{2}^{18}$O+2O${\;}_{2}^{2-}$═4OH-+18O2↑ | |
| B. | 向0.1 mol•L-1、pH=1的NaHA溶液中加入NaOH溶液:H++OH-═H2O | |
| C. | 以金屬銀為陽極電解飽和硫酸銅溶液:Cu2++2H2O═2Cu+O2↑+4H+ | |
| D. | NH4Al(SO4)2溶液中加入Ba(OH)2溶液SO42-使完全沉淀:Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 N、P、As、Ga、Cr等元素化合物種類繁多,具有重要的研究價值和應用價值.請回答下列問題:
N、P、As、Ga、Cr等元素化合物種類繁多,具有重要的研究價值和應用價值.請回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | HClO是弱酸,所以NaClO是弱電解質 | |
| B. | HCl溶液和NaCl溶液均通過離子導電,所以HCl和NaCl均是離子化合物 | |
| C. | 1.00 mol NaCl中含有6.02×1023個NaCl分子 | |
| D. | 純凈礦泉水、鋁熱劑、漂白粉均為混合物 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com