
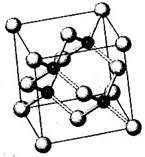
 N、P、As、Ga、Cr等元素化合物種類繁多,具有重要的研究價值和應用價值.請回答下列問題:
N、P、As、Ga、Cr等元素化合物種類繁多,具有重要的研究價值和應用價值.請回答下列問題:分析 (1)原子晶體熔、沸點高、硬度大,金剛石是原子晶體,因此AlN和Si3N4都屬于原子晶體;
(2)PCl3中心原子P原子成3個σ鍵,P原子價層電子對是為3+1=4,含有1對孤對電子對,空間構型為三角錐形;
(3)根據基態電子排布規律,寫出As原子的基態電子排布式,計算不同類型(s、p、d、f等)的電子比;
(4)Cr的原子序數為24,電子排布為1s22s22p63s23p63d54s1,價層電子排布式為3d54s1;
(5)GaAs晶體中As分布于晶胞體心,Ga分布于頂點和面心,而NaCl中陰陽離子分別位于晶胞的頂點、面心以及棱和體心;
(6)一般情況下,同周期元素從左到右第一電離能逐漸增大;
(7)利用價層電子對互斥模型判斷分子的空間構型、雜化方式.
解答 解:(1)二者在真空條件下的穩定存在的最高溫度2200℃和1900℃,硬度類似金剛石,常用作耐高溫和耐磨材料,原子晶體熔、沸點高、硬度大,金剛石是原子晶體,因此AlN和Si3N4都屬于原子晶體,
故答案為:原子;
(2)PCl3中心原子P原子成3個σ鍵,P原子價層電子對是為3+1=4,含有1對孤對電子對,雜化軌道數為4,雜化方式為sp3,其空間構型為三角錐,
故答案為:三角錐形;
(3)根據基態電子排布規律,As原子的基態電子排布式為:1s22s22p63s23p63d104s24p3,因此s電子:p電子:d電子=8:15:10,
故答案為:s電子:p電子:d電子=8:15:10;
(4)Cr的原子序數為24,電子排布為1s22s22p63s23p63d54s1,價層電子排布式為3d54s1,
故答案為:3d54s1;
(5)GaAs晶體中As分布于晶胞體心,Ga分布于頂點和面心,而NaCl中陰陽離子分別位于晶胞的頂點、面心以及棱和體心,二者結構不同,
故答案為:不同;
(6)同周期元素從左到右第一電離能逐漸增大,則第一電離能:As>Ga,
故答案為:>;
(7)(CH3)3Ga中Ga形成3個δ鍵,沒有孤電子對,為sp2雜化,
故答案為:sp2雜化.
點評 本題考查較為綜合,涉及元素周期律的遞變規律、分子空間構型以及雜化類型的判斷、電子排布式以及氫鍵等知識,題目難度較大,注意相關基礎的把握和方法的積累.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
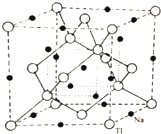 ⅢA族的硼、鋁、鎵、銦、鉈等元素在化合物中通常表現出+3價,含ⅢA族元素的化合物在研究和生產中有許多重要用途.請回答下列問題.
ⅢA族的硼、鋁、鎵、銦、鉈等元素在化合物中通常表現出+3價,含ⅢA族元素的化合物在研究和生產中有許多重要用途.請回答下列問題.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
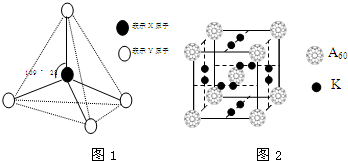 現有A、B、C、D、E、F六種物質或粒子,其中A、B、C、D都具有如圖1所示的結構或結構單元,(圖中正四面體以外可能有的部分未畫出,虛線不表示化學鍵或分子間作用力,X、Y可以相同也可以不同).A、B的晶體類型相同.工業上利用單質A的同素異形體能與B物質發生置換反應,制取單質G的粗產品.C、D、E、F含有相等的電子數,且D是陽離子,D與F的組成元素相同.C、E、F的晶體類型相同,由E構成的物質常溫下呈液態.
現有A、B、C、D、E、F六種物質或粒子,其中A、B、C、D都具有如圖1所示的結構或結構單元,(圖中正四面體以外可能有的部分未畫出,虛線不表示化學鍵或分子間作用力,X、Y可以相同也可以不同).A、B的晶體類型相同.工業上利用單質A的同素異形體能與B物質發生置換反應,制取單質G的粗產品.C、D、E、F含有相等的電子數,且D是陽離子,D與F的組成元素相同.C、E、F的晶體類型相同,由E構成的物質常溫下呈液態. .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 近年來,我國的霧霾問題引起政府和群眾的高度關切,一般認為細顆粒物(即PM2.5,指直徑小于或等于2.5微米的顆粒物)的指標與霧霾天氣密切相關.與此同時,光化學煙霧也開始抬頭,它是由非甲烷烴和NOx的排放引起的,嚴重時天空會出現彩色云霧,屬于一種重污染現象.臭氧濃度升高是光化學煙霧形成的標志.請回答下列相關問題:
近年來,我國的霧霾問題引起政府和群眾的高度關切,一般認為細顆粒物(即PM2.5,指直徑小于或等于2.5微米的顆粒物)的指標與霧霾天氣密切相關.與此同時,光化學煙霧也開始抬頭,它是由非甲烷烴和NOx的排放引起的,嚴重時天空會出現彩色云霧,屬于一種重污染現象.臭氧濃度升高是光化學煙霧形成的標志.請回答下列相關問題:| 實驗序號 | c(NH4+)/mol•L-1 | c(NO2-)/mol•L-1 | ν/mol•L-1•s-1 |
| 1 | 0.0100 | 0.200 | 5.4×10-7 |
| 2 | 0.0200 | 0.200 | 1.08×10-6 |
| 3 | 0.200 | 0.040 | 2.16×10-6 |
| 4 | 0.200 | 0.060 | 3.24×10-6 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

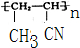
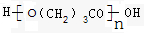
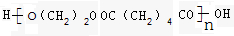 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 處理廢棄物 | B. | 治理污染點 | C. | 減少有毒物排放 | D. | 杜絕污染源 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com