
| 物質 | V2O5 | NH4VO3 | VOSO4 | (VO2)2SO4 |
| 溶解性 | 難溶 | 難溶 | 可溶 | 易溶 |
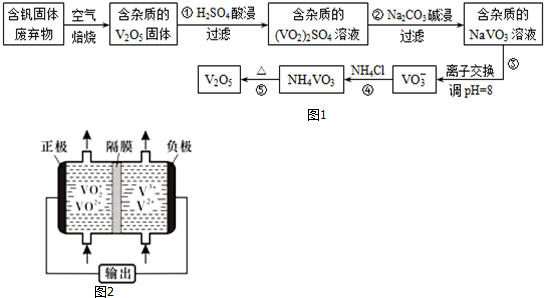
分析 反應①用硫酸溶解含釩固體廢棄物(含有SiO2、Al2O3及其他殘渣),生成(VO2)2SO4和硫酸鋁,SiO2等不溶性雜質過濾除去;反應②是用碳酸鈉溶液與(VO2)2SO4和硫酸鋁反應,與(VO2)2SO4反應生成NaVO3,碳酸根離子與鋁離子水解相互促進生成Al(OH)3沉淀;反應④是NaVO3溶液與氯化銨反應生成NH4VO3沉淀,加熱NH4VO3分解為V2O5,據此解答(1)(2)(3);
(4)據已知熱化學方程式和待求熱化學方程式,利用蓋斯定律計算;
(5)釩液流電池放電時負極發生氧化反應,正極發生還原反應,充電時,陽極發生氧化反應;
(6)先據反應方程式和滴定數據計算(VO2)2SO4溶液中c(VO2+)的物質的量濃度,再計算該(VO2)2SO4溶液中釩的含量.
解答 解:反應①用硫酸溶解含釩固體廢棄物(含有SiO2、Al2O3及其他殘渣),生成(VO2)2SO4和硫酸鋁,SiO2等不溶性雜質過濾除去;反應②是用碳酸鈉溶液與(VO2)2SO4和硫酸鋁反應,與(VO2)2SO4反應生成NaVO3,碳酸根離子與鋁離子水解相互促進生成Al(OH)3沉淀;反應④是NaVO3溶液與氯化銨反應生成NH4VO3沉淀,加熱NH4VO3分解為V2O5,
(1)用硫酸溶解含釩固體廢棄物(含有SiO2、Al2O3及其他殘渣),生成(VO2)2SO4和硫酸鋁,溶液中的陽離子除氫離子外還有VO2+和Al3+,
故答案為:VO2+和Al3+;
(2)含雜質的(VO2)2SO4溶液用碳酸鈉溶液堿浸生成含雜質的NaVO3溶液,Al(OH)3不溶于弱堿,所以反應②堿浸后濾出的固體主要成分是Al(OH)3,
故答案為:Al(OH)3;
(3)據工藝流程圖可知,反應④的離子方程式為VO3-+NH4+=NH4VO3↓,故答案為:VO3-+NH4+=NH4VO3↓;
(4)已知①4Al(s)+3O2(g)═2Al2O3(s)△H1=-a kJ/mol
②4V(s)+5O2(g)═2V2O5(s)△H2=-b kJ/mol
據蓋斯定律,(①×5-②×3)÷2得:10Al(s)+3V2O5(s)=5Al2O3(s)+6V(s)△H=-$\frac{5a-3b}{2}$kJ/mol,
故答案為:10Al(s)+3V2O5(s)=5Al2O3(s)+6V(s)△H=-$\frac{5a-3b}{2}$kJ/mol;
(5)釩液流電池放電時負極發生氧化反應,據圖可知,電極反應式為V2+-e-=V3+,正極發生還原反應,充電時,陽極發生氧化反應,電極反應式為VO2+-e-+H2O=VO2++2H+;
故答案為:V2+-e-=V3+;VO2+-e-+H2O=VO2++2H+;
(6)據滴定數據,結合離子方程式c(VO2+)=$\frac{2×0.025L×0.100mol/L}{0.024L}$=0.2083mol/L,所以1L溶液中含V的質量為0.2083mol/L×1L×51g/mol=10.6g,
故答案為:10.6.
點評 本題考查物質分離和提純,為高頻考點,涉及原電池和電解池原理、滴定實驗及計算、蓋斯定律、物質分離和提純等知識點,明確實驗原理及物質性質、基本操作方法等是解本題關鍵,難點是分析流程圖中每一步可能發生的反應或基本操作方法,注意結合題給信息分析解答,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| 實驗操作 | 實驗目的 | |
| A | 向苯和苯酚混合溶液中滴加過量濃溴水 | 除去混合溶液中的苯酚 |
| B | 向待測液中加入飽和碳酸鈉溶液 | 鑒別乙酸、乙酸乙酯、乙醇 |
| C | 向3mL5%CuSO4溶液中滴加3-4滴1%氫氧化鈉溶液,再向其中加入0.5mL乙醛,加熱 | 檢驗醛基 |
| D | 將溴乙烷與氫氧化鈉溶液共熱,冷卻,繼續滴加硝酸銀溶液 | 檢驗溴乙烷中的溴元素 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 4種、3種 | B. | 3種、4種 | C. | 6種、2種 | D. | 2種、6種 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 4.4gCO2、N2O成的混合氣體中含有的質子數為2.2NA | |
| B. | 7.8gNa2O2中陰離子數目為0.2NA | |
| C. | 2L0.5mol•L-1(NH4)2SO4溶液中含有的NH4+離子數為2NA | |
| D. | 化學反應中每消耗1molO2,轉移的電子數一定是4NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1s22s22p5 | B. | 1s22s22p2 | C. | 1s22s22p63s1 | D. | 1s22s22p63s2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com