
| 步驟 | 實驗操作 | 現象記錄 |
| 1 | 將1g細銅絲放入盛有10mL1mol•L-1HNO3的試管中加熱 | 銅絲表面有無色氣體逸出,溶液變成天藍色 |
| 2 | 將1g細銅絲放入盛有10mL的14mol•L-1HNO3的試管中 | 產生大量紅棕色氣體,溶液變為綠色,綠色由深到淺,未見到藍色. |
| 3 | 將硝酸銅晶體配成飽和溶液 | 深藍色溶液 |
| 4 | 向飽和的硝酸銅溶液中不斷滴加14mol•L-1HNO3 | 溶液仍呈深藍色 |
分析 (1)根據實驗記錄和已知信息“Cu2+可以和NH3形成類似[Ag(NH3)2]+的復雜分子[Cu(NH3)4]2+,NH3分子可以換成氣體分子或離子”可知判斷所得溶液呈天藍色的化學粒子符號;
(2)與(1)對比:飽和硝酸銅溶液中c((NO3-)大,根據已知信息推測使飽和硝酸銅溶液呈深藍色的化學粒子符號;
(3)根據濃硝酸與銅絲反應產生大量紅棕色氣體,溶液變為綠色,綠色由深到淺,未見到藍色可知,Cu(NO3)2溶液的綠色是由藍色的Cu(NO3)2溶液和黃色的HNO3溶液(溶有NO2)的兩者混合而成的;可以通過向飽和的硝酸銅溶液中通入大量的NO2氣體或將濃硝酸與銅絲反應后的溶液加熱或用水稀釋等方法進行證明.
解答 解:(1)根據實驗記錄和已知信息“Cu2+可以和NH3形成類似[Ag(NH3)2]+的復雜分子[Cu(NH3)4]2+,NH3分子可以換成氣體分子或離子”可知:稀硝酸與銅絲反應后,所得溶液呈天藍色的化學粒子符號是:[Cu(H2O)4]2+,
故答案為:[Cu(H2O)4]2+;
(2)與(1)對比:飽和硝酸銅溶液中c((NO3-)大,根據已知信息推測:使飽和硝酸銅溶液呈深藍色的化學粒子符號可能是:[Cu(H2O)4-x(NO3)x](2-x)(1<x<4),
故答案為:[Cu(H2O)4-x(NO3)x](2-x)(1<x<4);
(3)由實驗記錄:濃硝酸與銅絲反應產生大量紅棕色氣體,溶液變為綠色,綠色由深到淺,未見到藍色,由此可見,Cu(NO3)2溶液的綠色是由藍色的Cu(NO3)2溶液和黃色的HNO3溶液(溶有NO2)的兩者混合而成的;驗證方案:方案①向飽和的硝酸銅溶液中通入大量的NO2氣體;方案②將濃硝酸與銅絲反應后的溶液加熱;方案③用水稀釋,
故答案為:可能是還原產物NO2溶入其中引起的;方案①向飽和的硝酸銅溶液中通入大量的NO2氣體;方案②將濃硝酸與銅絲反應后的溶液加熱;方案③用水稀釋.
點評 本題考查了性質實驗方案的設計,題目難度中等,明確題中信息為解答關鍵,注意熟練掌握性質實驗方案設計與評價的原則,試題側重考查學生的分析、理解能力及靈活應用能力.


 暑假作業海燕出版社系列答案
暑假作業海燕出版社系列答案 本土教輔贏在暑假高效假期總復習云南科技出版社系列答案
本土教輔贏在暑假高效假期總復習云南科技出版社系列答案 暑假作業北京藝術與科學電子出版社系列答案
暑假作業北京藝術與科學電子出版社系列答案科目:高中化學 來源: 題型:選擇題
| A. | 蛋白質都屬于天然有機高分子化合物,且都不溶于水 | |
| B. | 用灼燒聞氣味的方法可以區別人造絲(纖維素)和蠶絲 | |
| C. | 人體內不含纖維素水解酶,人不能消化纖維素,因此蔬菜中的纖維素對人沒有用處 | |
| D. | 油脂是一種高分子化合物,可水解為甘油和高級脂肪酸 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 乙醇發生了還原反應 | B. | 反應中有紅黑顏色交替變化的現象 | ||
| C. | 銅是此反應的催化劑 | D. | 生成物是乙醛 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 弱酸 | HClO2 | HF | HCN | HS |
| Ka/mol•L-1 | 1×10-2 | 6.3×10-4 | 4.9×10-10 | K1=9.1×10-8 K2=1.1×10-12 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①Na,K,Rb ②N,P,As ③O,S,Se ④Na,P,Cl元素的電負性隨原子序數增大而遞增的是④ | |
| B. | 下列原子中,①1s22s22p63s23p1②1s22s22p63s23p2③1s22s22p63s23p3④1s22s22p63s23p4對應的第一電離能最大的是④ | |
| C. | 某元素的逐級電離能分別為738、1451、7733、10540、13630、17995、21703,該元素在第三周期第 IIA族 | |
| D. | 以下原子中,①1s22s22p63s23p2②1s22s22p3③1s22s22p2④1s22 s22p63s23p4半徑最大的是① |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
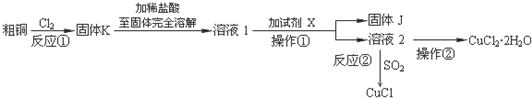
 能源與資源是現代社會發展的重要支柱.
能源與資源是現代社會發展的重要支柱.
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫常壓下,28gN2含有的原子數為2NA | |
| B. | 1mol•L-1AlCl3溶液中含有的Cl-數為3NA | |
| C. | 標準情況下,2.24LCCl4含有的分子數NA | |
| D. | 常溫常壓下,22.4LCl2與足量鐵充分反應,轉移電子數為2NA |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com