
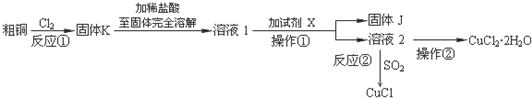
分析 粗銅(含雜質Fe)與氯氣反應生成氯化鐵和氯化銅,加稀鹽酸溶解,形成氯化鐵和氯化銅溶液,再加試劑x為CuO或氫氧化銅等調節pH,使鐵離子轉化為氫氧化鐵沉淀,過濾得到的固體J為氫氧化鐵,溶液2為氯化銅溶液,通入二氧化硫,二氧化硫與銅離子發生氧化還原反應生成CuCl,氯化銅溶液在HCl氛圍中蒸發結晶得到CuCl2•2H2O;
(1)流程中固體K溶于稀鹽酸的目的是防止銅離子水解,試劑X、固體J的物質分別為氧化銅,氫氧化鐵,根據從溶液中提取溶質晶體的操作分析;
(2)根據信息可知:SO2與銅離子反應生成CuCl白色沉淀和SO42-;
(3)陰極上是得到電子發生還原反應,Cu2+得到電子生成CuCl,結合電荷守恒配平書寫電極反應.
解答 解:粗銅(含雜質Fe)與氯氣反應生成氯化鐵和氯化銅,加稀鹽酸溶解,形成氯化鐵和氯化銅溶液,再加CuO或氫氧化銅等調節pH,使鐵離子轉化為氫氧化鐵沉淀,過濾得到的固體2為氫氧化鐵,溶液2為氯化銅溶液,通入二氧化硫,二氧化硫與銅離子發生氧化還原反應生成CuCl,氯化銅溶液在HCl氛圍中蒸發結晶得到CuCl2•2H2O;
(1)流程中固體K溶于稀鹽酸的目的是防止銅離子水解,試劑X、固體J的物質分別為氧化銅,氫氧化鐵,選B,
故答案為:防止Cu2+水解;冷卻結晶,B;
(2)根據信息可知:在加熱條件下,SO2與銅離子反應生成CuCl白色沉淀和SO42-,其反應的離子方程式為:2Cu2++2Cl-+SO2+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+4H++SO42-;
故答案為:2Cu2++2Cl-+SO2+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+4H++SO42-;
(3)以石墨為電極,電解CuCl2溶液時發現陰極上也會有部分CuCl析出,陰極上是得到電子發生還原反應,Cu2+得到電子生成CuCl,電極反應為:Cu2++e-+Cl-=CuCl,
故答案為:Cu2++e-+Cl-=CuCl.
點評 本題以實驗室制備氯化銅為背景,考查了物質的制備實驗操作、離子檢驗、除雜質、離子方程式的書寫、原電池原理的應用等,題目涉及的知識點較多,側重于基礎知識的綜合應用的考查,難度中等.


科目:高中化學 來源: 題型:多選題
| A. | HI、H2、I2的濃度相等且不再改變時 | B. | 混合氣體的顏色深淺不再變化時 | ||
| C. | 混合氣體的平均摩爾質量不變時 | D. | v(HI):v(H2):v(I2)=2:1:1時 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na[Au(CN)2]可溶于水 | |
| B. | 化合物Na[Au(CN)2]中金元素的化合價為+2 | |
| C. | 金化學性質穩定,不與任何物質反應 | |
| D. | 在提煉過程中含金元素的物質始終作氧化劑 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 200mL含9.5g MgCl2的溶液 | |
| B. | 31g Na2O溶于水配成1L溶液 | |
| C. | 4%的H2SO4溶液(ρ=1.025g•cm-3) | |
| D. | 213mL 0.5mol•L-1鹽酸和82mL 0.5mol•L-1鹽酸的混合液 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 溫度/℃ | 500 | 525 | 550 | 575 | 600 |
| 平衡轉化率/% | 93.5 | 90.5 | 85.6 | 80.0 | 73.7 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 步驟 | 實驗操作 | 現象記錄 |
| 1 | 將1g細銅絲放入盛有10mL1mol•L-1HNO3的試管中加熱 | 銅絲表面有無色氣體逸出,溶液變成天藍色 |
| 2 | 將1g細銅絲放入盛有10mL的14mol•L-1HNO3的試管中 | 產生大量紅棕色氣體,溶液變為綠色,綠色由深到淺,未見到藍色. |
| 3 | 將硝酸銅晶體配成飽和溶液 | 深藍色溶液 |
| 4 | 向飽和的硝酸銅溶液中不斷滴加14mol•L-1HNO3 | 溶液仍呈深藍色 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,11.2L己烷中含有分子的數目為0.5NA | |
| B. | 1mol/L CH3COOH溶液中含有CH3COOH分子的數目為NA | |
| C. | 78g 苯中含有碳碳雙鍵的數目為3NA | |
| D. | 10g46%的乙醇水溶液中所含氫原子數目為1.2NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 研究工業廢棄物的處理和防治具有重要的意義.
研究工業廢棄物的處理和防治具有重要的意義.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .A的一種晶體的晶胞如圖1甲,乙圖中
.A的一種晶體的晶胞如圖1甲,乙圖中 和
和 表示的是同種原子,即乙是8個甲無隙并置的結果,若按甲圖中虛線方向切乙,得到圖2的a~d,圖中正確的是a.
表示的是同種原子,即乙是8個甲無隙并置的結果,若按甲圖中虛線方向切乙,得到圖2的a~d,圖中正確的是a.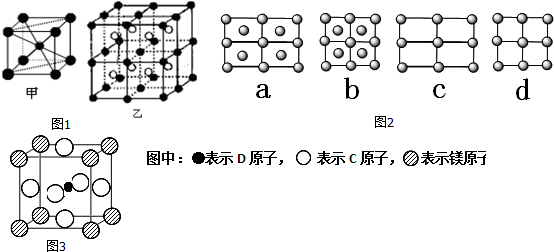
 . 據報道,只含鎂、C和D三種元素的晶體竟然具有超導性.該晶體的結構(如圖3示)可看作由鎂原子和C原子在一起進行面心立方密堆積,該晶體的化學式為MgCNi3.晶體中每個
. 據報道,只含鎂、C和D三種元素的晶體竟然具有超導性.該晶體的結構(如圖3示)可看作由鎂原子和C原子在一起進行面心立方密堆積,該晶體的化學式為MgCNi3.晶體中每個 原子周圍距離最近的
原子周圍距離最近的 原子有12個.
原子有12個.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com