
| 乙炔水化法 | 乙烯氧化法 | |
| 原料 | 乙炔、水 | 乙烯、空氣 |
| 反應條件 | HgSO4、100~125℃ | PdCl2-CuCl2、100~125℃ |
| 平衡轉化率 | 乙炔平衡轉化率90%左右 | 乙烯平衡轉化率80%左右 |
| 日產量 | 2.5噸(某設備條件下) | 3.6噸(相同設備條件下) |
| 原料生產工藝過程 | |
| 乙炔 | CaCO3$\stackrel{①850-1100℃}{→}$CaO$→_{1100℃}^{②+C、電爐}$CaC2$\stackrel{③飽和食鹽水}{→}$C2H2 |
| 乙烯 | 來源于石油裂解氣 |
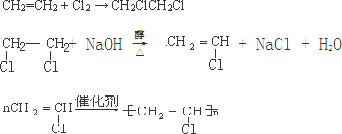 .
. 分析 (1)乙炔水化法是乙炔和水加成反應得到制乙醛,乙烯氧化法是乙烯被催化氧化生成制乙醛;
(2)對比“乙烯氧化法”、“乙炔水化法”兩種方法,從化學反應速率、日產量、消耗的催化劑的性質以及能源的消耗角度來回答;
(3)從表一來看,兩者反應條件溫度相當,雖然乙烯氧化法的轉化率略小于乙炔水化法,但反應快、日產量比其高得多;
從表二來看,乙炔的制取要經過多步反應制得,且消耗大量的熱能、電能,較難獲得;乙烯來源于石油裂解氣,消耗的總能量比乙炔少,且較容易獲得;
(4)依據轉化率,增大壓強消耗能源,增大投入等因素分析;
(5)以乙烯為原料,通過3步可以制得聚氯乙烯,方案為乙烯和氯氣發生加成反應生成1,2-二氯乙烷,1,2-二氯乙烷在氫氧化鈉溶液中發生消去反應得到氯乙烯,在引發劑作用下發生聚合反應生成聚乙烯.
解答 解:(1)乙炔水化法是乙炔和水加成反應得到制乙醛,反應的化學方程式為:CH≡CH+H2O$→_{△}^{催化劑}$CH3CHO,
乙烯氧化法是乙烯被催化氧化生成制乙醛,反應的化學方程式為:2CH2=CH2+O2$→_{△}^{催化劑}$2CH3CHO,
故答案為:CH≡CH+H2O$→_{△}^{催化劑}$CH3CHO,2CH2=CH2+O2$→_{△}^{催化劑}$2CH3CHO;
(2)對比“乙烯氧化法”、“乙炔水化法”兩種方法,從環境保護和能耗角度可以知道,兩者反應條件溫度相當,但乙炔水化法制乙醛使用的是汞鹽催化劑,汞鹽的毒性大,從產率和產量角度可以看出:雖然乙烯氧化法的轉化率略小于乙炔水化法,但反應快、日產量比其高得多,
對比“乙烯氧化法”、“乙炔水化法”兩種方法,乙炔的制取要經過多步反應制得,且消耗大量的熱能、電能,但是乙烯來源于石油裂解氣,消耗的總能量比乙炔少,且較容易獲得等,
故答案為:兩者反應條件溫度相當,但乙炔水化法制乙醛使用的是汞鹽催化劑,汞鹽的毒性大,雖然乙烯氧化法的轉化率略小于乙炔水化法,但反應快、日產量比其高得多,乙炔的制取要經過多步反應制得,且消耗大量的熱能、電能,但是乙烯來源于石油裂解氣,消耗的總能量比乙炔少,且較容易獲得等;
(3)從表一來看,兩者反應條件溫度相當,雖然乙烯氧化法的轉化率略小于乙炔水化法,但反應快、日產量比其高得多;
從表二來看,乙炔的制取要經過多步反應制得,且消耗大量的熱能、電能,較難獲得;乙烯來源于石油裂解氣,消耗的總能量比乙炔少,且較容易獲得,所以從化學反應速率角度分析,在相同條件下,兩種制取乙醛的方法中乙烯氧化法快,
故答案為:乙烯氧化法快;
(4)若將上述兩種方法的反應條件,均增加“100個標準大氣壓”,原料轉化率會再增大一些,但在實際生產中卻不采用這樣的方法是因為兩種方法在相同反應條件下,轉化率已經很高,增大壓強將消耗能量和增加設備預算,不經濟,
故答案為:因為兩種方法在相同反應條件下,轉化率已經很高,增大壓強將消耗能量和增加設備預算,不經濟;
(5)以乙烯為原料,通過3步可以制得聚氯乙烯,方案為乙烯和氯氣發生加成反應生成1,2-二氯乙烷,1,2-二氯乙烷在氫氧化鈉溶液中發生消去反應得到氯乙烯,在引發劑作用下發生聚合反應生成聚乙烯,反應的化學方程式為: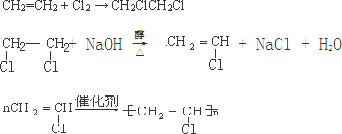 ,
,
故答案為: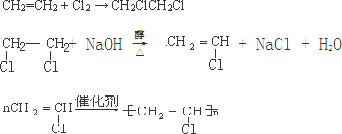 .
.
點評 本題考查有機物的合成及計算,注意表格數據的分析和物質的合成的關系,能利用數據和流程分析判斷是解題關鍵,對學生能力的考查較高,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 2HCl+2Na═2NaCl+H2↑ | |
| B. | 2CH3COOH+Ca(ClO)2═2HClO+Ca(CH3COO)3 | |
| C. | I2+2NaClO3═2NaIO3+Cl2 | |
| D. | 4HCl(濃)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0~1min,CO的平均反應速率為o.5mol/(L•min) | |
| B. | 增大壓強,化學反應速率加快,K增大 | |
| C. | H2S的平衡轉化率為71.4% | |
| D. | 平衡后,又加入CO、H2各1mol,平衡逆動 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 溫度 | 0 | 10 | 20 | 40 | 60 | 80 |
| KIO3g/100g水 | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 密度(g/cm3) | 熔點(℃) | 沸點(℃) | 溶解性 | |
| 環己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 環己烯 | 0.81 | -103 | 83 | 難溶于水 |
 、SO2、CO2及水蒸氣,混合氣體通過試劑的順序是
、SO2、CO2及水蒸氣,混合氣體通過試劑的順序是
查看答案和解析>>
科目:高中化學 來源: 題型:填空題

查看答案和解析>>
科目:高中化學 來源: 題型:填空題


查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸點/℃ | 80 | 59 | 156 |
| 在水中的溶解度 | 微溶 | 微溶 | 微溶 |

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 甲苯能使酸性高錳酸鉀溶液褪色 | |
| B. | 甲苯與濃硫酸和濃硝酸混酸反應生成2,4,6-三硝基甲苯 | |
| C. | 1mol甲苯能與3mol氫氣發生加成反應 | |
| D. | 甲苯可以燃燒并產生濃烈的黑煙 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com