

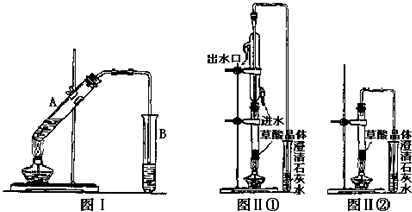
分析 圖(a)中,加熱條件下,銅和濃硫酸發生氧化還原反應生成二氧化硫、硫酸銅和水,二氧化硫和碳酸鈉、S在C中反應生成硫代硫酸鈉,二氧化硫屬于酸性氧化物,且有毒,不能直接排空,應該用堿液吸收;
(1)步驟1:利用壓強差檢驗裝置的氣密性;
步驟2:二氧化硫具有還原性,屬于酸性氧化物,且有毒,不能直接排空,可以用酸性高錳酸鉀溶液或堿性溶液吸收;
步驟3:Na2S2O3在酸性溶液中不能穩定存在,在堿性條件下穩定存在;
步驟4:從溶液中獲取溶質,需要采用蒸發濃縮、冷卻結晶、過濾的方法;
(2)氯氣具有強氧化性,硫代硫酸鈉具有還原性,二者發生氧化還原反應生成硫酸鈉、硫酸和鹽酸;
氯水中含有氯離子,影響硫代硫酸鈉還原性的判斷;
(3)由題意可知,BaCrO4用鹽酸溶解轉化為Cr2O2-7,由元素守恒及已知方程式可得關系式:2Ba2+~2BaCrO4~Cr2O2-7~3I2~6Na2S2O3,結合消耗的Na2S2O3利用關系式計算溶液中n(Ba2+),進而計算c(Ba2+).
解答 解:圖(a)中,加熱條件下,銅和濃硫酸發生氧化還原反應生成二氧化硫、硫酸銅和水,二氧化硫和碳酸鈉、S在C中反應生成硫代硫酸鈉,二氧化硫屬于酸性氧化物,且有毒,不能直接排空,應該用堿液吸收;
(1)步驟1:氣密性檢驗方法為關閉分液漏斗活塞,往D廣口瓶中加水至浸沒長導管;打開K1、關閉K2,用酒精燈微熱圓底燒瓶,若D長導管口有氣泡產生,停止加熱后長導管內形成一段水柱,說明氣密性良好,
步驟2:二氧化硫具有還原性,屬于酸性氧化物,且有毒,不能直接排空,可以用酸性高錳酸鉀溶液氧化而被酸性高錳酸鉀溶液吸收,亞硫酸酸性大于碳酸,所以能和碳酸氫鈉、NaOH溶液反應而被氫氧化鈉溶液或飽和碳酸氫鈉溶液吸收,
步驟3:Na2S2O3在酸性溶液中不能穩定存在,在堿性條件下能穩定存在,為了防止硫代硫酸鈉發生反應,要控制溶液的pH接近或不小于7;
步驟4:從溶液中獲取溶質,需要采用蒸發濃縮、冷卻結晶、過濾的方法,
故答案為:關閉分液漏斗活塞,往D廣口瓶中加水至浸沒長導管;打開K1、關閉K2,用酒精燈微熱圓底燒瓶,若D長導管口有氣泡產生,停止加熱后長導管內形成一段水柱,說明氣密性良好;
ACD;接近或不小于7;Na2S2O3在酸性溶液中不能穩定存在;蒸發濃縮;冷卻結晶;
(2)氯氣具有強氧化性,硫代硫酸鈉具有還原性,二者發生氧化還原反應生成硫酸鈉、硫酸和鹽酸,反應方程式為Na2S2O3+4Cl2+5H2O=Na2SO4+H2SO4+8HCl;
氯水中含有氯離子,影響硫代硫酸鈉還原性的判斷,所以不正確,
故答案為:Na2S2O3+4Cl2+5H2O=Na2SO4+H2SO4+8HCl;不正確,因為氯水中含有氯離子;
(3)由題意可知,BaCrO4用鹽酸溶解轉化為Cr2O2-7,由元素守恒及已知方程式可得關系式:2Ba2+~2BaCrO4~Cr2O2-7~3I2~6Na2S2O3,消耗的Na2S2O3為0.018L×0.01mol/L,則n(Ba2+)=0.018L×0.01mol/L×$\frac{1}{3}$=0.00006mol,故溶液中c(Ba2+)=$\frac{6×1{0}^{-5}mol}{0.025L}$=2.4×10-3 mol•L-1,
故答案為:2.4×10-3 mol•L-1.
點評 本題考查物質制備實驗方案設計,為高頻考點,涉及氣密性檢驗、對實驗裝置及步驟的分析評價、物質的分離提純、氧化還原反應滴定,注意圖a中各個裝置的作用及發生的反應,難點是確定(3)中各個物理量之間的關系,題目難度中等.


 唐印文化課時測評系列答案
唐印文化課時測評系列答案 導學與測試系列答案
導學與測試系列答案科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | △H1>△H2 | B. | a=b | C. | a>b | D. | a<b |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 乙炔水化法 | 乙烯氧化法 | |
| 原料 | 乙炔、水 | 乙烯、空氣 |
| 反應條件 | HgSO4、100~125℃ | PdCl2-CuCl2、100~125℃ |
| 平衡轉化率 | 乙炔平衡轉化率90%左右 | 乙烯平衡轉化率80%左右 |
| 日產量 | 2.5噸(某設備條件下) | 3.6噸(相同設備條件下) |
| 原料生產工藝過程 | |
| 乙炔 | CaCO3$\stackrel{①850-1100℃}{→}$CaO$→_{1100℃}^{②+C、電爐}$CaC2$\stackrel{③飽和食鹽水}{→}$C2H2 |
| 乙烯 | 來源于石油裂解氣 |
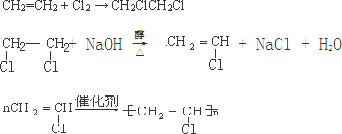 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
.
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

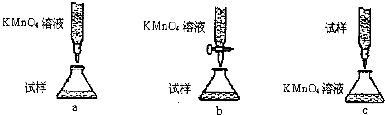
| 序號 | 操作 | 可能出現的現象 | 結論 |
| ① | 向a試管中滴加幾滴0.01mol/L的KMnO4 | 若溶液褪色 | 則假設1成立 |
| 若溶液不褪色 | 則假設2或3成立 | ||
| ② | 向b試管中滴加幾滴品紅 | 若溶液褪色 | 則假設1或3成立 |
| 若溶液不褪色 | 則假設2成立 | ||
| ③ | 向c試管中滴加幾滴淀粉-KI溶液 | 則假設3成立 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com