
| A. | 測得0.10mol/LCH3COOH溶液中存在較多的CH3COOH分子 | |
| B. | 比較等濃度等體積的鹽酸、CH3COOH溶液與足量Zn反應生成H2的體積 | |
| C. | 比較等濃度等體積的鹽酸、CH3COOH溶液與等量NaOH溶液反應后放出的熱量 | |
| D. | 0.10mol/LNH4Cl呈酸性,0.1mol/LCH3COONH4溶液呈中性 |
分析 部分電離的電解質是弱電解質,要說明CH3COOH是弱酸,只要證明CH3COOH部分電離即可,可以根據一定濃度溶液pH、其鈉鹽溶液酸堿性等判斷.
解答 解:A.測得0.10mol/LCH3COOH溶液中存在較多的CH3COOH分子,說明醋酸部分電離,所以能說明醋酸是弱酸,故A不選;
B.等濃度等體積的鹽酸、CH3COOH溶液與足量Zn反應生成H2的體積相同,與酸性強弱無關,則不能證明醋酸是弱酸,故B選;
C.弱酸電離過程會吸熱,所以等濃度等體積的鹽酸、CH3COOH溶液與等量NaOH溶液反應后放出的熱量,醋酸少,說明醋酸是弱酸,故C不選;
D.0.10mol/LNH4Cl呈酸性,0.1mol/LCH3COONH4溶液呈中性,說明醋酸根離子的水解程度與銨根離子的水解程度相同,即醋酸為弱酸,故D不選;
故選B.
點評 本題考查強弱電解質的判斷,明確強弱電解質的根本區別是解本題關鍵,題目難度不大,注意把握弱電解質在溶液中部分電離的特點,側重于考查的分析能力和應用能力.


科目:高中化學 來源: 題型:選擇題
| A. | 使甲基橙變紅色的溶液中:Na+、Fe2+、MnO4-、AlO2- | |
| B. | $\frac{{K}_{w}}{c({H}^{+})}$=1×10-12mol/L,的溶液中:NH4+、Ca2+、Cl-、NO3- | |
| C. | PH=0的溶液中:Al3+、Ag(NH3)2+、I-、SO42- | |
| D. | 加入Mg能放出H2的溶液中:Ca2+、NH4+、ClO-、NO3- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 制作印刷電路板:Fe3++Cu═Cu2++Fe2+ | |
| B. | 等物質的量的Ba(OH)2與NH4HSO4在稀溶液中反應:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| C. | Ca(OH)2溶液與足量Ca(HCO3)2溶液反應:Ca2++2HCO3-+2OH-═2CaCO3↓+2H2O+CO32- | |
| D. | 新制飽和氯水中加入石灰石可提高溶液中HClO濃度:CaCO3+2Cl2+H2O═Ca2++2Cl-+CO2↑+2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 陽離子 | K+、Cu2+、Fe3+、Ca2+、Fe2+ |
| 陰離子 | Cl-、CO32-、NO3-、SO42-、SiO32- |
| A. | 溶液中一定含有的離子是K+、Cl-、CO32-、NO3-、SO42- | |
| B. | Ⅰ中加入鹽酸生成無色氣體的離子方程式是CO32-+2H+═CO2↑+H2O | |
| C. | 原溶液中的K+、Cl-、NO3-存在與否無法確定 | |
| D. | Ⅱ中產生白色沉淀的離子方程式是Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氟利昂-12的結構式為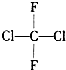 ,該分子是平面型分子 ,該分子是平面型分子 | |
| B. | 苯與液溴混合后撤入鐵粉發生了加成反應 | |
| C. | 分子式為C4H9Cl的同分異構體共有4種 | |
| D. | 1mol蘋果酸(HOOCCHOHCH2COOH)可與3molNaHCO3發生反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
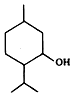
| A. | 薄荷醇屬于芳香烴的含氧衍生物 | |
| B. | 薄荷醇分子式為C10H20O,它是環己醇的同系物 | |
| C. | 薄荷醇環上的一氯取代物只有三種 | |
| D. | 在一定條件下,薄荷醇能與氫氣、溴水反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 實驗序號 | I | II | III |
| 鹽酸體積(mL) | 50.0 | 50.0 | 50.0 |
| 樣品質量/g | 9.2 | 15.7 | 27.6 |
| CO2體積/L (標準狀況) | 2.24 | 3.36 | 3.36 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com