
【題目】A、B、C為原子序數依次遞增的前四周期的元素,A的第一電離能介于鎂和硫兩元素之間,A單質晶體的晶胞結構如圖2所示。B的價電子排布為(n+1)sn(n+1)pn+2,C位于元素周期表的ds區,其基態原子不存在不成對電子。B與C所形成化合物晶體的晶胞如圖3所示。
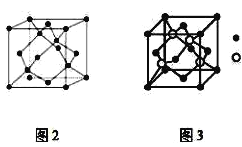
(1)A單質晶體屬于__晶體(填晶體類型)。其原子雜化方式為__。
(2)B與C所形成化合物晶體的化學式__。
(3)B與C所形成化合物晶體的密度為ag/cm3,則B原子之間最近距離為__cm。
【答案】原子 sp3 ZnS 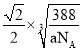 cm
cm
【解析】
A、B、C為原子序數依次遞增的前四周期的元素,B的價電子排布為(n+1)sn(n+1)pn+2,而n=2,故B為S元素;C位于位于元素周期表的ds區,其基態原子不存在不成對電子,則C為Zn;A的第一電離能介于鎂和硫兩元素之間,A單質晶體的晶胞結構中A原子與周圍4個原子形成正四面體,為空間延伸的立體網狀結構,則A為Si,據以上分析解答。
![]() 、B、C為原子序數依次遞增的前四周期的元素,A的第一電離能介于鎂和硫兩元素之間,A單質晶體的晶胞結構如圖2所示分析可知,A為硅形成的晶體,屬于原子晶體,其原子雜化方式為
、B、C為原子序數依次遞增的前四周期的元素,A的第一電離能介于鎂和硫兩元素之間,A單質晶體的晶胞結構如圖2所示分析可知,A為硅形成的晶體,屬于原子晶體,其原子雜化方式為![]() ;
;
故答案為:原子;sp3;
![]() 的價電子排布為
的價電子排布為![]() ,有三個電子層,外層為6個電子,B為S原子,C位于元素周期表的ds區,其基態原子不存在不成對電子,判斷為Zn原子,B與C所形成化合物晶體的化學式為:ZnS;
,有三個電子層,外層為6個電子,B為S原子,C位于元素周期表的ds區,其基態原子不存在不成對電子,判斷為Zn原子,B與C所形成化合物晶體的化學式為:ZnS;
故答案為:ZnS;
![]() B與C所形成化合物晶體的密度為ag/cm3,則B原子之間最近距離為
B與C所形成化合物晶體的密度為ag/cm3,則B原子之間最近距離為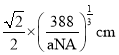 ;
;
故答案為: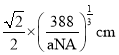 。
。


科目:高中化學 來源: 題型:
【題目】為測定某抗酸藥中碳酸鈣固體的純度(另一種成分為淀粉),稱取12.5g此藥片置于燒杯中,加入過量的稀鹽酸,測得反應過程中燒杯和藥品的總重量隨時間的變化數據如下:
反應時間/s | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
燒杯和藥品的總重/g | 310.0 | 306.8 | 305.9 | 305.7 | 305.6 | 305.6 | 305.6 |
計算:(1)共收集到標準狀況下CO2的體積____________________;
(2)該樣品中碳酸鈣的質量分數________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鹵素化學豐富多彩,能形成鹵化物、鹵素互化物、多鹵化物等多種類型的化合物。
(1)氣態氟化氫中存在二聚分子(HF)2,這是由于__。
(2)I3+屬于多鹵素陽離子,根據VSEPR模型推測I3+的空間構型為__,中心I原子的雜化軌道類型為__。
(3)基態溴原子的電子排布式為__,碘原子價電子的電子排布圖為__。
(4)鹵素互化物如IBr、ICl等與鹵素單質結構相似、性質相近。Cl2、IBr、ICl沸點由高到低的順序為__,I和Cl相比,電負性較大的是__,ICl中I元素的化合價為__。
(5)請推測①HClO4、②HIO4、③H5IO6[可寫成(HO)5IO]三種物質的酸性由強到弱的順序為__(填序號)。
(6)鹵化物RbICl2加熱時會分解為晶格能相對較大的鹵化物和鹵素互化物,該反應的化學方程式為__。RbICl2的晶體結構與CsCl相似,晶胞邊長為685.5pm,RbICl2晶胞中含有__個氯原子,RbICl2晶體的密度是__gcm-3(只要求列算式,不必計算出數值.阿伏伽德羅常數為NA)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將氣體A、B置于固定容積為2 L的密閉容器中,發生如下反應:3A(g)+B(g) ![]() 2C(g)+2D(g),反應進行到10 s末,達到平衡,測得A的物質的量為1.8 mol,B的物質的量為0.6 mol,C的物質的量為0.8 mol。
2C(g)+2D(g),反應進行到10 s末,達到平衡,測得A的物質的量為1.8 mol,B的物質的量為0.6 mol,C的物質的量為0.8 mol。
(1)用C表示10 s內反應的平均反應速率為______________。
(2)反應前A的物質的量濃度是______________。
(3)10 s末,生成物D的濃度為______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在已經發現的一百多種元素中,除稀有氣體外,非金屬元素只有十多種,但與生產生活有密切的聯系。
(1)短周期中可以做半導體材料的元素的最高價氧化物與燒堿溶液反應的離子方程式是:__________;
(2)為了提高煤的利用率,常將其氣化或液化,其中一種液化是將氣化得到的氫氣和一氧化碳在催化劑作用下轉化為甲醇,寫出該化學反應方程式為____________;
(3)氮是動植物生長不可缺少的元素,合成氨的反應對人類解決糧食問題貢獻巨大,反應如下:N2(g)+3H2(g)![]() 2NH3(g)。
2NH3(g)。
①合成氨的反應中的能量變化如圖所示。該反應是________反應(填“吸熱”或“放熱”)。
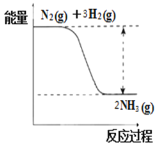
②在一定條件下,將2.5mol N2和7.5mol H2的混合氣體充入體積為2L的固定閉容器中發生反應:N2(g)+ 3H2(g) ![]() 2NH3(g),5分鐘末時達到平衡,測得容器內的壓強是開始時的0.9倍,則5分鐘內用氨氣表示該反應的平均化學反應速率為:V(NH3)=____________;氫氣達到平衡時的轉化率是_____________(保留小數點后一位);
2NH3(g),5分鐘末時達到平衡,測得容器內的壓強是開始時的0.9倍,則5分鐘內用氨氣表示該反應的平均化學反應速率為:V(NH3)=____________;氫氣達到平衡時的轉化率是_____________(保留小數點后一位);
(4)美國阿波羅宇宙飛船上使用了一種新型裝置,其構造如圖所示:
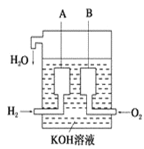
A,B兩個電極均由多孔的碳塊組成。該電池的正極反應式為:________________;若將上述裝置中的氫氣換成甲烷,其余都不改變,對應裝置的負極反應方程式為_________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某烴A是有機化學工業的基本原料,其產量可以用來衡量一個國家的石油化工發展水平,A還是一種植物生長調節劑,A可發生如圖所示的一系列化學反應,其中①②③屬于同種反應類型。根據如圖回答下列問題:

(1)寫出結構簡式:B___,D___。
(2)寫出②、④兩步反應的化學方程式,并注明反應類型
②__,反應類型__。
④__,反應類型__。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學小組以環己醇![]() 制備環己烯.已知:
制備環己烯.已知:
密度(g/cm3) | 溶點(℃) | 沸點(℃) | 溶解性 | |
環已醇 | 0.96 | 25 | 161 | 能溶于水 |
環已烯 | 0.81 | ﹣103 | 83 | 難溶于水 |
(1)制備粗品將12.5mL環已醇加入試管A中,再加入1ml濃硫酸,搖勻后放入碎瓷片,緩慢加熱至反應完全,在試管C內得到環已烯粗品。
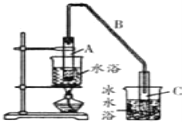
①A中碎瓷片的作用是_____________,導管B除了導氣外還具有的作用是_______。
②寫出環已醇制備環已烯的化學反應方程式___________________________。
③試管C置于冰水浴中的目的是____________________________。
(2)環已烯粗品中含有環已醇和少量酸性雜質等需要提純。
①加入飽和食鹽水,振蕩、靜置、分層,水在_______層(填上或下),分液后用_________(填入編號)洗滌。
a.KMnO4溶液 b.稀 H2SO4 c.Na2CO3溶液
②再將環已烯熱餾,蒸餾時要加入生石灰,目的是_____________________________。
③收集產品時,控制的溫度應在_________左右。
(3)以下區分環已烯精品和粗品的方法,合理的是_______。
a.用酸性高錳酸鉀溶液 b.用金屬鈉 c.溴水
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是實驗室制取SO2并驗證SO2的某些性質的裝置(夾持裝置和加熱裝置已略,氣密性已檢驗),請回答下列問題:
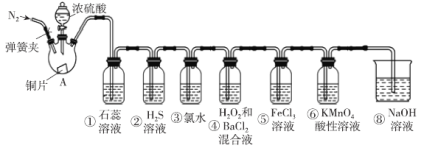
(1)在A中發生反應的化學方程式為___。
(2)①中的實驗現象為紫色石蕊溶液___。
②中的實驗現象為___,寫出此化學反應方程式___。
③中的實驗現象是___,寫出此化學反應方程式___。
④中的實驗現象是___,寫出此化學反應方程式___。
⑤中的現象是溶液由黃色變為淺綠色,其反應的離子方程式為___。
(3)能體現出SO2還原性的實驗序號是___。
(4)實驗結束后需要通入N2,其目的是___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】過渡金屬元素在日常生活中有廣泛的應用。
(1)金屬釩在材料科學上有重要作用,被稱為“合金的維生素”,基態釩原子的價層電子的排布式為__;基態Ni原子核外有__種運動狀態不同的電子,M層的電子云有__種不同的伸展方向。
(2)第四周期元素的第一電離能隨原子序數增大,總趨勢是逐漸增大的,但Se的第一電離能低于As,原因是___。
(3)NO2-與鈷鹽形成的配離子[Co(NO2)6]3-可用于檢驗K+的存在。大π鍵可用符號![]() 表示,其中m代表參與形成大π鍵的原子數,n為各原子的單電子數(形成σ鍵的電子除外)和得電子數的總和(如苯分子中的大π鍵可表示為
表示,其中m代表參與形成大π鍵的原子數,n為各原子的單電子數(形成σ鍵的電子除外)和得電子數的總和(如苯分子中的大π鍵可表示為![]() ,則NO2-中大π鍵應表示為__。
,則NO2-中大π鍵應表示為__。
(4)Mn3+在水溶液中容易歧化為MnO2和Mn2+,下列說法合理的是___。
A.Mn3+的價電子構型為3d4,不屬于較穩定的電子構型
B.根據Mn2+的電子構型可知,Mn2+中不含成對電子
C.第四周期元素中,錳原子價電子層中未成對電子數最多
D.Mn2+與Fe3+具有相同的價電子構型,所以它們的化學性質相似
(5)FeO是離子晶體,其晶格能可通過圖中的Born—Haber循環計算得到。
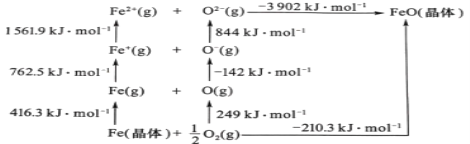
可知,O原子的第一電子親和能為___kJmol-1,FeO晶格能為___kJmol-1。
(6)銅與氧可形成如圖所示的晶胞結構,其中Cu均勻地分散在立方體內部,a、b的坐標參數依次為(0,0,0)、(![]() ,
,![]() ,
,![]() ),則d點的坐標參數為___,已知該晶體的密度為ρgcm-3,NA是阿伏加德羅常數的值,則晶胞參數為___pm。
),則d點的坐標參數為___,已知該晶體的密度為ρgcm-3,NA是阿伏加德羅常數的值,則晶胞參數為___pm。

(列出計算式即可)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com