
【題目】鹵素化學豐富多彩,能形成鹵化物、鹵素互化物、多鹵化物等多種類型的化合物。
(1)氣態氟化氫中存在二聚分子(HF)2,這是由于__。
(2)I3+屬于多鹵素陽離子,根據VSEPR模型推測I3+的空間構型為__,中心I原子的雜化軌道類型為__。
(3)基態溴原子的電子排布式為__,碘原子價電子的電子排布圖為__。
(4)鹵素互化物如IBr、ICl等與鹵素單質結構相似、性質相近。Cl2、IBr、ICl沸點由高到低的順序為__,I和Cl相比,電負性較大的是__,ICl中I元素的化合價為__。
(5)請推測①HClO4、②HIO4、③H5IO6[可寫成(HO)5IO]三種物質的酸性由強到弱的順序為__(填序號)。
(6)鹵化物RbICl2加熱時會分解為晶格能相對較大的鹵化物和鹵素互化物,該反應的化學方程式為__。RbICl2的晶體結構與CsCl相似,晶胞邊長為685.5pm,RbICl2晶胞中含有__個氯原子,RbICl2晶體的密度是__gcm-3(只要求列算式,不必計算出數值.阿伏伽德羅常數為NA)。
【答案】HF分子間形成氫鍵 V形 sp3 [Ar]3d104s24p5 ![]() BrI>ICl>Cl2 Cl +1 ①②③ RbICl2
BrI>ICl>Cl2 Cl +1 ①②③ RbICl2![]() RbCl+ICl 8
RbCl+ICl 8 ![]()
【解析】
(1)F的電負性很大,HF分子之間形成氫鍵;
(2)I3+的成鍵數為2,孤對電子數為![]() ×(7-1-2×1)=2,與水相似;
×(7-1-2×1)=2,與水相似;
(3)Br的原子序數為35,最外層有7個電子,為4s、4p電子;碘原子價電子數與Br相同,為5s、5p電子;
(4)分子晶體,相對分子質量越大,沸點越高,原子的得電子能力越強,則電負性越大;
(5)含非羥基氧原子個數越多,酸性越強;
(6)根據元素守恒和原子守恒判斷產物,及反應方程式;根據氯化鈉的晶胞圖分析;利用均攤法計算出晶胞中含有離子個數,再根據密度公式計算即可。
![]() 的電負性很大,HF分子之間形成氫鍵;
的電負性很大,HF分子之間形成氫鍵;
故答案為:HF分子間形成氫鍵;
![]() 的成鍵數為2,孤對電子數為
的成鍵數為2,孤對電子數為![]() ,與水相似,則空間構型為V形,中心I原子的雜化軌道類型為
,與水相似,則空間構型為V形,中心I原子的雜化軌道類型為![]() ;
;
故答案為:V形;![]() ;
;
![]() 的原子序數為35,最外層有7個電子,為4s、4p電子,則電子排布式為
的原子序數為35,最外層有7個電子,為4s、4p電子,則電子排布式為![]() ,碘原子價電子的電子排布圖為
,碘原子價電子的電子排布圖為![]() ;
;
故答案為:![]() ;
;![]() ;
;
![]() 分子晶體,相對分子質量越大,沸點越高,則沸點為
分子晶體,相對分子質量越大,沸點越高,則沸點為![]() ,氯原子得電子能力強于I,所以Cl的電負性大,Cl顯
,氯原子得電子能力強于I,所以Cl的電負性大,Cl顯![]() 價,故I顯
價,故I顯![]() 價;
價;
故答案為:![]() ;Cl;
;Cl;![]() ;
;
![]() 含非羥基氧原子個數越多,酸性越強,非羥基氧分別為3、3、1,但非金屬性
含非羥基氧原子個數越多,酸性越強,非羥基氧分別為3、3、1,但非金屬性![]() ,則酸性為
,則酸性為![]() ;
;
故答案為:![]() ;
;
![]() 根據元素守恒和原子守恒判斷產物為RbCl和ICl,則反應方程式為
根據元素守恒和原子守恒判斷產物為RbCl和ICl,則反應方程式為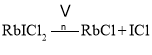 ;已知氯化鈉的晶胞圖為:
;已知氯化鈉的晶胞圖為: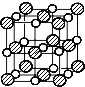 ,晶胞中含有4個陽離子和4個陰離子,
,晶胞中含有4個陽離子和4個陰離子,![]() 的晶體結構與NaCl相似,
的晶體結構與NaCl相似,![]() 晶胞中含有4個陰離子,則Cl原子為8個;1個晶胞中含有4個
晶胞中含有4個陰離子,則Cl原子為8個;1個晶胞中含有4個![]() ,根據
,根據![]() ,所以該晶胞的密度是
,所以該晶胞的密度是![]() ;
;
故答案為:RbICl2![]() RbCl+ICl;8;
RbCl+ICl;8;![]() 。
。


科目:高中化學 來源: 題型:
【題目】下列反應屬于消去反應的是(反應條件省略)( )
A.![]() -CH3CH2OH →
-CH3CH2OH →![]() -CH2=CH2↑+ H2O
-CH2=CH2↑+ H2O
B.CH3CH2CH3 + Br2→CH3CH2CH2Br + HBr
C.CH3CH2CHO + H2→CH3CH2CH2OH
D.2CH3CH2CH2OH + 2O2→CH3CH2CHO + 2H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氫氣既是一種優質的能源,又是一種重要化工原料,高純氫的制備是目前的研究熱點。
(1)甲烷水蒸氣催化重整是制備高純氫的方法之一,甲烷和水蒸氣反應的熱化學方程式是:
CH2(g)+2H2O(g)![]() CO2(g)+4H2(g) △H=+165.0kJ·mol-1
CO2(g)+4H2(g) △H=+165.0kJ·mol-1
已知反應器中存在如下反應過程:
I.CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H1=+206.4kJ·mol-1
CO(g)+3H2(g) △H1=+206.4kJ·mol-1
II.CO(g)+H2O(g)![]() CO2(g)+H2(g) △H2
CO2(g)+H2(g) △H2
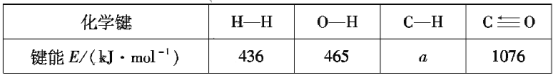
根據上述信息計算:a=___、△H2=___。
(2)某溫度下,4molH2O和lmolCH4在體積為2L的剛性容器內同時發生I、II反應,達平衡時,體系中n(CO)=bmol、n(CO2)=dmol,則該溫度下反應I的平衡常數K值為___(用字母表示)。
(3)欲增大CH4轉化為H2的平衡轉化率,可采取的措施有___(填標號)。
A.適當增大反應物投料比武n(H2O):n(CH4)
B.提高壓強
C.分離出CO2
(4)H2用于工業合成氨:N2+3H2![]() 2NH3。將n(N2):n(H2)=1:3的混合氣體,勻速通過裝有催化劑的反應器反應,反應器溫度變化與從反應器排出氣體中NH3的體積分數φ(NH3)關系如圖,反應器溫度升高NH3的體積分數φ(NH3)先增大后減小的原因是___。
2NH3。將n(N2):n(H2)=1:3的混合氣體,勻速通過裝有催化劑的反應器反應,反應器溫度變化與從反應器排出氣體中NH3的體積分數φ(NH3)關系如圖,反應器溫度升高NH3的體積分數φ(NH3)先增大后減小的原因是___。

某溫度下,n(N2):n(H2)=1:3的混合氣體在剛性容器內發生反應,起始氣體總壓為2×l07Pa,平衡時總壓為開始的90%,則H2的轉化率為___,氣體分壓(p分)=氣體總壓(p總)×體積分數,用某物質的平衡分壓代替物質的量濃度也可以表示化學平衡常數(記作Kp),此溫度下,該反應的化學平衡常數Kp=___(分壓列計算式、不化簡)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】寫出下列物質的名稱:
A.(CH3)3CCH(CH3)(CH2)2CH(C2H5)2 A的名稱是________;
B.(CH3)3CC≡CCH2CH3 B的名稱是____;
C.![]() C的名稱是_____
C的名稱是_____
D.CH2OHCH(C2H5) CH2OH D的名稱是________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知充分燃燒a g乙炔氣體時生成1mol二氧化碳氣體和液態水,并放出熱量b kJ,則乙炔燃燒的熱化學方程式正確的是()
A.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=+2b kJ/mol
B.C2H2(g)+![]() O2(g)=2CO2(g)+H2O(l);ΔH=-2b kJ/mol
O2(g)=2CO2(g)+H2O(l);ΔH=-2b kJ/mol
C.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=-2b kJ/mol
D.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=-b kJ/mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】二氯化二硫(S2Cl2)是一種重要的化工原料,常用作橡膠硫化劑,改變生橡膠受熱發粘、遇冷變硬的性質。查閱資料可知S2Cl2具有下列性質:
物理性質 | 毒性 | 色態 | 揮發性 | 熔點 | 沸點 |
劇毒 | 金黃色液體 | 易揮發 | -76℃ | 138℃ | |
化學性質 | ①300 ℃以上完全分解 ②S2Cl2+Cl2 ③遇高熱或與明火接觸,有引起燃燒的危險 ④受熱或遇水分解放熱,放出腐蝕性煙氣 | ||||
(1)制取少量S2Cl2
實驗室可利用硫與少量氯氣在110~140℃反應制得S2Cl2粗品,氯氣過量則會生成SCl2。
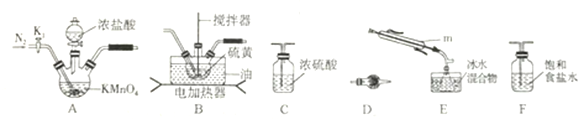
①儀器m 的名稱為__________,裝置F 中試劑的作用是_________。
②裝置連接順序: A![]() ______
______![]()
![]()
![]() E
E![]() D。
D。
③實驗前打開K1,通入一段時間的氮氣排盡裝置內空氣。實驗結束停止加熱后,再通入一段時間的氮氣,其目的是_____________。
④為了提高S2Cl2的純度,實驗的關鍵是控制好溫度和____________。
(2)少量S2Cl2泄漏時應噴水霧減慢其揮發(或擴散),并產生酸性懸濁液,但不要對泄漏物或泄漏點直接噴水,其原因是______________。
(3)S2Cl2遇水會生成SO2、HCl兩種氣體,某同學設計了如下實驗方案來測定該混合氣體中SO2的體積分數。
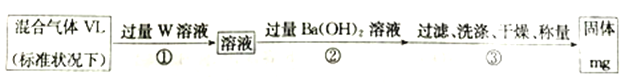
①W溶液可以是_____(填標號)。
a.H2O2溶液 b.KMnO4溶液(硫酸酸化) c.氯水
②該混合氣體中二氧化硫的體積分數為_________(用含V、m 的式子表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:有機物A的產量可以用來衡量一個國家的石油化工發展水平。現以A為主要原料合成乙酸乙酯,其合成路線如圖1所示。
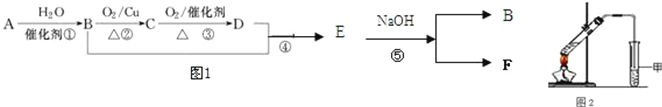
(1)B分子中官能團的名稱是________,D中官能團的名稱是_________;反應①的反應類型是__________反應。
(2)反應②的化學方程式是________________________________________,反應⑤的化學方程式是_________________________________________________。
(3)①某同學用如圖2所示的實驗裝置制取少量乙酸乙酯.實驗結束后,試管甲中上層為透明的、不溶于水的油狀液體。上述實驗中試管甲中試劑為___________________,其作用是(填字母)_____________。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在飽和碳酸鈉溶液中的溶解度比在水中更小,有利于分層析出
D.加速酯的生成,提高其產率
②在實驗室利用B和D制備乙酸乙酯的實驗中,若用1mol B和1mol D充分反應,_____(能/不能)生成1mol 乙酸乙酯,原因是_____________________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C為原子序數依次遞增的前四周期的元素,A的第一電離能介于鎂和硫兩元素之間,A單質晶體的晶胞結構如圖2所示。B的價電子排布為(n+1)sn(n+1)pn+2,C位于元素周期表的ds區,其基態原子不存在不成對電子。B與C所形成化合物晶體的晶胞如圖3所示。
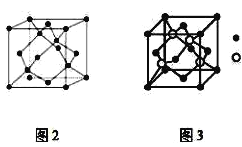
(1)A單質晶體屬于__晶體(填晶體類型)。其原子雜化方式為__。
(2)B與C所形成化合物晶體的化學式__。
(3)B與C所形成化合物晶體的密度為ag/cm3,則B原子之間最近距離為__cm。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用NA表示阿伏加德羅常數的值。下列敘述中不正確的是( )
A.標準狀況下,2.24LCH4中所含碳氫鍵的數目為0.4NA
B.1mol重水與1mol水中,中子數比為2:1
C.5.6g乙烯(C2H4)和環丁烷(C4H8)的混合氣體中含有的碳原子數為0.4NA
D.標準狀況下,11.2L二氧化碳與和足量的過氧化鈉反應,轉移的電子數為0.5NA
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com